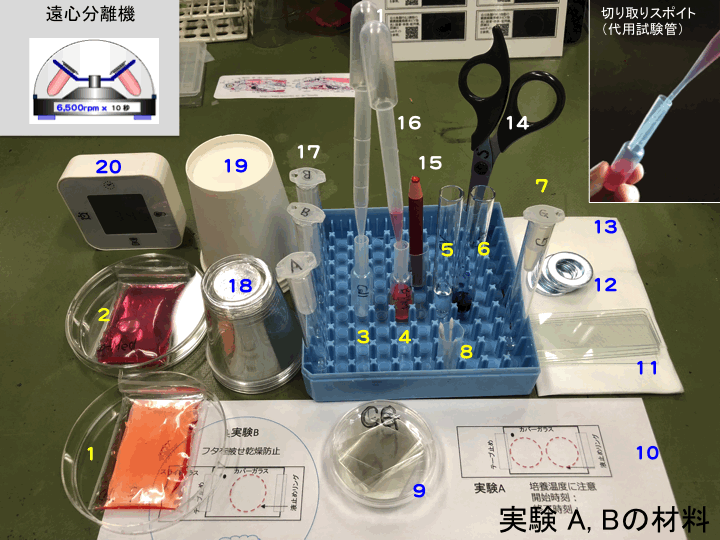
[Top Page]�ցA[Set-TopPage]�ցA ���������w[Gallery]���A �זE�����w�K�̎�u�����A
�o�[�`�����������ώ@��[�̂̊�{10����] �� �A [�����F���_�ꗗ]�ց@
[�}�N���g�D�̘b������]���A [�זE��������W]��
�k�w�K�}�g���b�N�X�l�ցA���u�`�֖߂�F �u�`�P�ցA �u�`�Q�ցA �u�`�R���@ [�g�D�w����g��]��
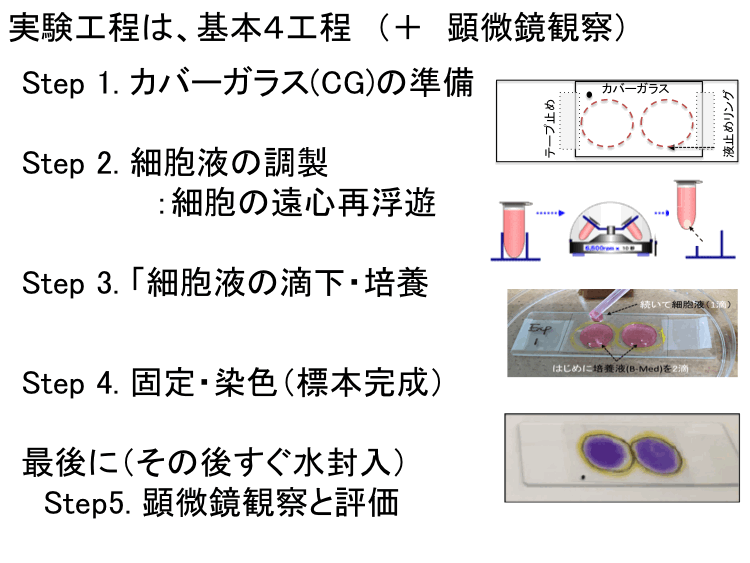
��Set�T�F�זE�|�{�����iExp.A, B�j�̎��{�v�� �F�ڎ�����
�i�����L�b�g�̃��N�G�X�g���@���j
��2018CG�זE�����@:�}������W�A ��u�҂ցF������� �A 2018�����w��
| �� �{�ҁu�l���鐶���w�F�זE�����Ɋ�Â������w�v�͉��L�uSet 1�`�U�v�Ɋ�Â����{�����B �� Set-Top��Set 1�ł́A���K�u�`�̊T�v�������BSet2�[Set5�͍זE�����̎��{�v���ł���B �� ���p�l���u�b��W1�`�U�v�́A�זE�����w�K�Ɋ�Â������̂̐��藧���Ɋւ��b��i����j�B |
||||||
| Set-Top | Set�P�� | Set�Q�� | Set�R�� | Set�S�� | Set�T:�R�R | Set�U�� |
| �{�҂� �ڎ��� �i���L�j |
�{���K�� ��Ȏ��{ �ۑ�Ƙb�� |
�V�I���� �זE�W�{�ώ@ �F�\���Ɗώ@ |
�זE�|�{���� �@(�ޗ��ƕ��@) |
�זE���� �@�̈Ӗ��Ӌ` �@�F12�� |
�זE���� �F���{�v�� �F�������@ |
�z�z���� �e�L�X�g ���[�N�V�[�g |
| Set-Top�ւ� �N���b�N�ňړ� |
Set1�ւ� �N���b�N�ňړ� |
Set2�ւ� �N���b�N�ňړ� |
Set3�ւ� �N���b�N�ňړ� |
Set4�ւ� �N���b�N�ňړ� |
���̃V�[�g �ڎ��� |
Set6�ւ� �N���b�N�ňړ� |
| �u�`�z�z�e�L�X�g�� �����u�`�X���C�h�A�ȈՍזE�����}�j���A���A���[�N�V�[�gPDF�A �֘A�����F�����w�K���e�\���_�A�זE�����w�K����u�҂ցF����ƌ����A �̂̒��g�̕`�����A�@���������A�@�זE�����A�@BioMTX�@�A�o�[�`�����������ώ@���A �g�D�w����g���� |
||||||
�{�V�[�g�kSet 5�l�̖ڎ��F�זE�|�{�����iExp.A, B�j�̎��{�v��
�i�����L�b�g�̃��N�G�X�g���@���j
1. �����H���̊T�v�i�͂��߂��E����A&B�̔�r�E�������{�̃|�C���g�j�A
2a. �����ޗ��ꗗ�F����ƃ|�C���g�@�@2.b. �����ޗ��̎ʐ^���H���ʂ̕K�v���i���X�g�A
3. �����L�b�g�\���i�̐��ʎZ�o�@�i3.1 Exp A�A3.2 Exp B)�F���N�G�X�g�O�̊m�F
��4.�̖ڎ��F�͂��߂� �זE�����L�b�g�������Ă݂������ցF�T�v������
4.1. �זE�Ǘ��ƗL�������ɂ��āA�@
4.2. ���N�G�X�g�O�̏m�F�A�@4.3 ���{�v��̗��ĂƋ��c�A 4.4 ���{�I����̏���
5. �����L�b�g�̕t�я����i���L�j�A�@�y��L��3. 4���܂Ƃ߂�PDF����p���J���z
�����@��������F�����}�j���A��[ ����A��PDF����p ]�A [����A/B�ꏏ��PDF����p ]�@����
�i�����w�K/���ގ������s���ꍇ�͂���PDF�̋L�ڕ��@���ŗD��Ƃ��܂��F���X�C�����Ă��܂��j
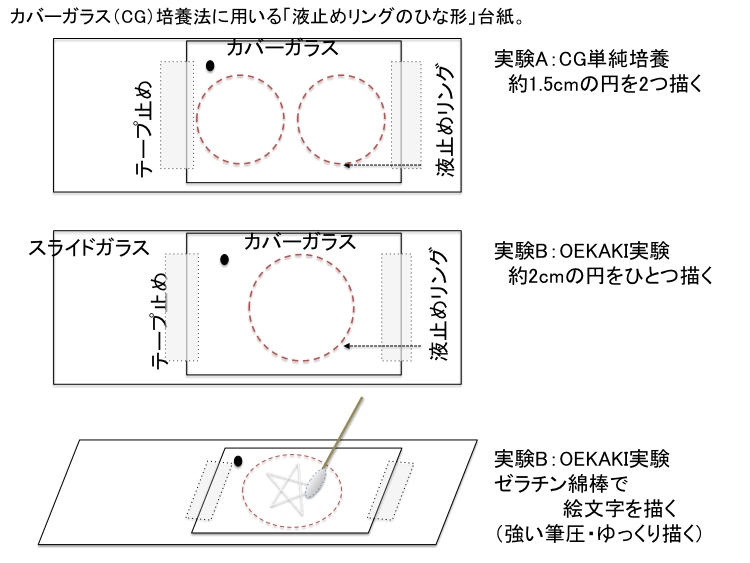
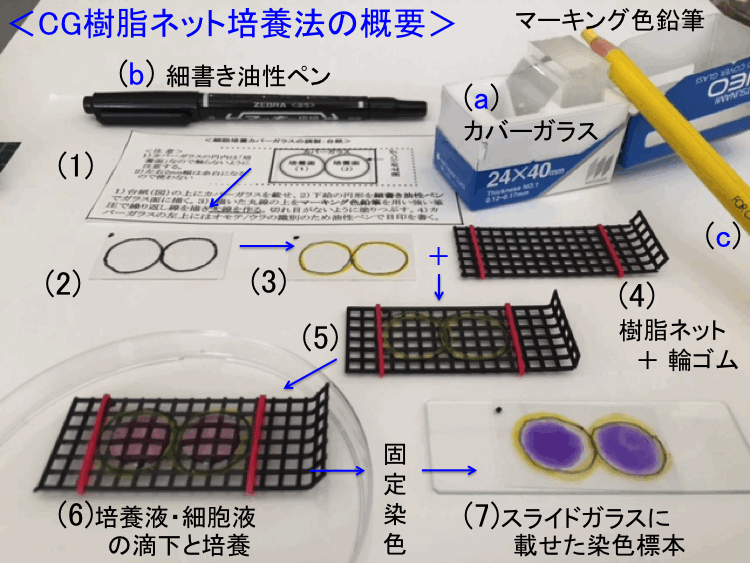
���� �ړ��FCG�זE�����w�K�̐}������W�� ����
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.0 �@�@�� Fig.00 �@�@�E Fig.000)
���擪�s�ֈړ���
�@���̃V�[�g�iSet 5�j�ł́A�O�o�́u�Z�b�g�R.�����}�j���A���v���邢�́u�}������W�FCG�זE�����v�Ɋ�Â��A���{�S���҂̕X�E�ϓ_��O���ɁA�@1.�����H���̘��ՓI�ȊT�v�\�L�A�@2.�����ޗ��ꗗ�F����ƃ|�C���g�A�@3.�����L�b�g�\���i�����ʎZ�o�@�iExp A�p�AExp B�p�j�ɂ��ĉ�����s���܂��B���̖ړI�́A��u�ґ����̏ꍇ�ł��v�����K�Ȍv��⏀�����\�Ƃ��邽�߂ł��B�Ȃ��A�����L�b�g�������Ă݂������ւ̃��b�Z�[�W�́u4.�R�R�v�ŎQ�Ƃł��B
��1. �����H���̊T�v�F�͂��߂Ɂ�
1.����A.B�̍H�����Ձi�T�v�j�Ƃ��̍���
| �H�� | ����A.�P���|�{���� �@ (�Q�T�[�N��/CG) |
����B.���G�`������ �@�i�P�T�[�N��/CG�j |
|
1 |
�J�o�[�K���X�̏��� |
SG���CG�̍��E�ӂ��e�[�v�~�߂̌�APFP�ʼnt�~�߉~���Q�`���i���`�𗘗p�j�BCG����ɂ͖����y���̖ڈ��t���B |
MC�����ς�CG�iMC/CG�j�����L�Ɠ��l�ɏ������APFP�ɂ��t�~�߉~�͂ЂƂB�����n��Gel��t�����Ȗ_�ŊG������`������30���B |
2 |
�זE�t�̒��� |
1) �זE�o�b�O�ɐ����U����^�����U�����A2) �o�b�O���J�����A3) �s�y�b�e�B���O�̌�A4) ���̍זE�t�����S�`���[�u�ɉ�����B 5) ���S�����̌�A6) �㐟�݂��̂āA7) ���^�I���ŗ]�t�������A8) �^�b�s���O�B 9) �|�{�t�������A10) ���J�Ƀs�y�b�e�B���O���A11)�זE���ĕ��V������B |
|
3 |
�זE |
�~����2�H��B-Med��H�����A2�Œ��������זE�t��1�H�̌�ɐÒu�|�{�B �|�{���x��28-32�� |
���������זE�t���~���ɂU�H�����A�K���ɐÒu���A�|�{90���ȏ�B �|�{���x��25-28�� |
4 |
�Œ�E���F |
�זE�t���̂āA�~����Fix�͂Q�H2���B�����ACV�͂Q�H3�������A����B�����B |
�זE�t���̂āAFix�͂Q�H2���B�����ACV��3�H3�������A����B�����B |
����. SG�F�X���C�h�K���X�ACG�F�J�o�[�K���X�A PFP�F�p���t�B�����M�AFB�זE�F�t�B�����o�b�O���eFHLS�זE�A�@CR�זE �F���S�ĕ��V�����זE�A MC�F���`���Z�����[�X�t�i�����A���u�~���̑�։t�j�A MC/CG�FMC�����ς݂�CG�A Gel�F�[���`���i�R���[�Q���̕ϐ����j�A B-Med�F�|�{�t�A Fix�F�Œ�t�A CV�F���F�t |
|||
�@�����Z���@�́u�}���WCG�זE�����v���Q�Ƃ��Ă��������i�ʃV�[�g�ֈړ��F�R�R�j�B
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.1 �@�@�� Fig.2 �@�@�E Fig.3)�@
���擪�s�ֈړ��E�ڎ�����
 �@
�@ �@
�@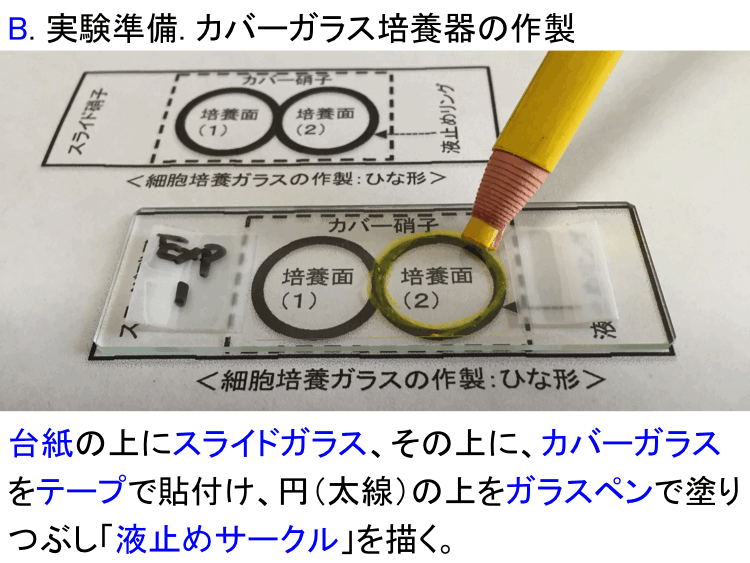
�@ �i�摜�N���b�N�Ŋg��\���F�@�� Fig.4 �@�@�� Fig.5 �@�@�E Fig.6 )
���擪�s�ֈړ��E�ڎ�����
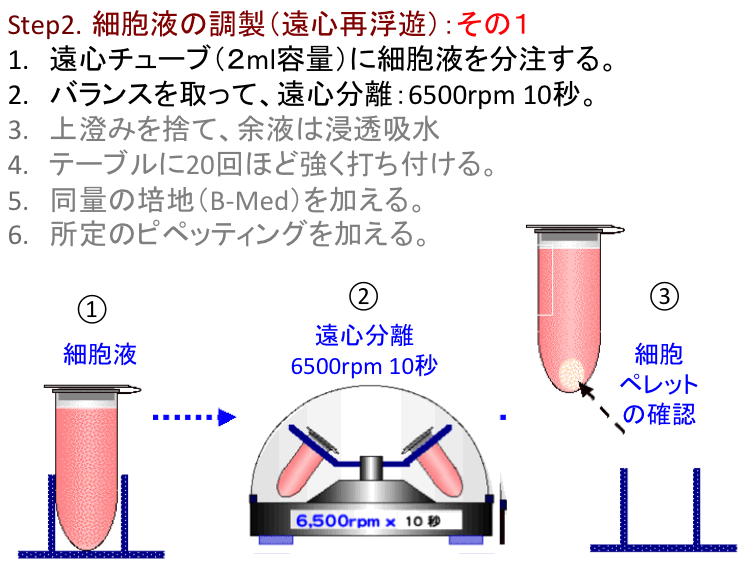 �@
�@ 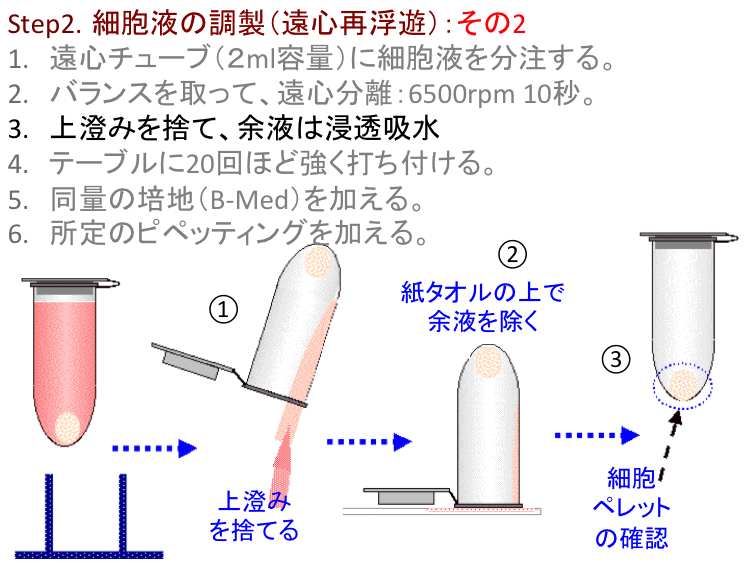 �@
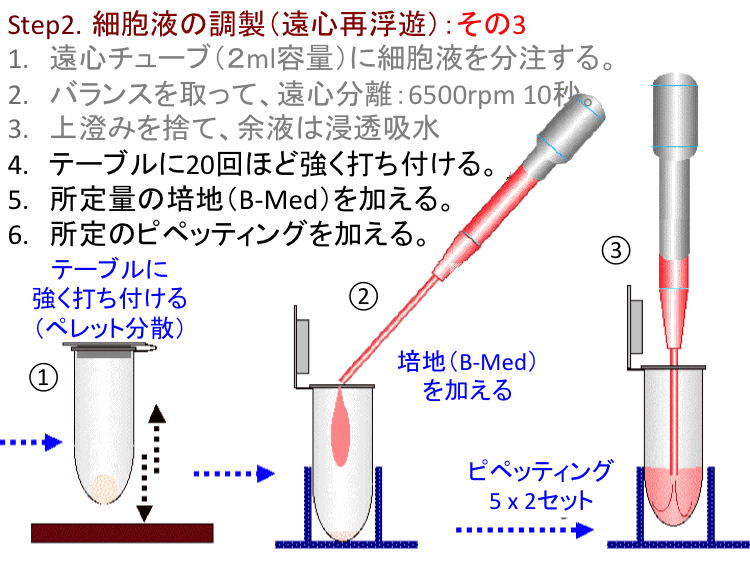
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.7 �@�@�� Fig.8 �@�@�E Fig.9 )
���擪�s�ֈړ��E�ڎ�����
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.13 �@�@�� Fig.14 �@�@�E Fig.15 )
���擪�s�ֈړ��E�ڎ�����
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.16 �@�@�� Fig.17 �@�@�E Fig.18 )
���擪�s�ֈړ��E�ڎ�����
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.22 �@�@�� Fig.23 �@�@�E Fig.24 )
���擪�s�ֈړ��E�ڎ�����
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.25 �@�@�� Fig.26 �@�@�E Fig.27)
Fig.25-27�̓X���C�h�K���X�̑���Ɂu�����l�b�g�v��CG�����S���~�߂����ȈՕ��@�B
���擪�s�ֈړ��E�ڎ�����
����A�EB�̑������|�C���g�i���ӎ����ł��F�H������̈ꕔ��\�L�j
|
�H�� |
����A.�P���|�{����(�Q�T�[�N��/CG) |
����B. ���G�`�������i�P�T�[�N��/CG�j |
1 |
�J�o�[�K���X�̏��� |
�V�i�J�o�[�K���X�iCG�j���g�p�B��̉t�~�߉~�̂���CG���E�̕�5mm���炢���e�[�v�~�߂���B������͕ۑ�(�\)�B |
���`���Z�����[�X�����J�o�[�K���X�i�i�j��p����B�Ȗ_�͎w��i�BGel�h���̎��͂�����苭���M���B�����͏d�v30���B�����ŕۑ��\�B |
�t�~�߃T�[�N����`���Ƃ��͏d�ˏ����ő����ɂ���B�e�[�v�~�߂̎���CG��SG����͂ݏo���Ȃ��悤�ɒ��ӁB�e�[�v�̊p�́u�܂荇�킹�v�ŗp����B |
|||
2 |
�זE�t�̒��� |
����A�͓��ʂ�B-Med�ōĕ��V�iFB�זE1.5ml�����S�����̌�A1.5ml�ōĕ��V�j�B |
����B�͔��ʂ�B-Med�ōĕ��V�i�Q�{�Z�x�ŗp����̂�FB�זE2ml�����S��1ml�ōĕ��V�j�B |
�H��3�̒��O�Ɏ��{�i���O���K���K�v�j�B�o�����X�m�F��ɉ��S�B���S�ĕ��V�͍זE�\�ʂ̐��ł���A���{���Ȃ��ꍇ�A�זE�̐ڒ��L�W�ɂ͐����Ԃ�v���B�]���ď㐟�݂͏\���ɏ����B |
|||
3 |
�זE |
���~����B-Med,CR�זE�̏��œH�����A15����i�C�Ӂj�A�E�~�֓�������B����5-10����ɌŒ�B�זE�����͉��x�ˑ��i�ቷ�ł͉^�x���x���ቺ�j�B28-30�����x���œK�B |
�|�{���Ԃ�60���ȏ�90���Ŋ����B�����h�~���s����90���ȏ���\�B�|�{���ԁi�҂����ԁj�͍זE�ɂƂ��Ă͎����I�Ȋ������ԁB�ޗ��̈Ӗ��Ӌ`�Ȃǂ����c�E�l�@����B 25-28�����x���K���ł��B |
�|�{�J�n��͓������Ȃ��B�|�{���Ԃ̍��قȂǂ̗��R��Web�u��������ƌ����v���Q�ƁB |
|||
4 |
�Œ�E���F |
A.B�Ő��F�t�̗ʂ��قȂ�B���S�E���S����ɔz�������B���G�E�������Ȃ����m�ۂ���B ���k��������ł͖��Q�ȌŒ�t��p����B |
|
���זE�Z�x�ɂ��āF�d�v�� �@����B�ł́u���Z�x�̍זE�t���g�p���邱�ƂŒ�ʏ[�U���x�v��}��A�~�Ώ�ɔz��זE�V�[�g�̌`����}��B |
|||
���⑫�F����A/B���ɍs���ꍇ�̍זE�����@ ��
�S�l�ǁi�S�l���j�̎���A,B���i�s�ōs�����߂ɂ́A�H��2�iStep 2�זE�t�̏����j�ɍH�v���K�v�ł���B���L�͂��̍זE�����@�̎���B �܂�A�H��(1)������������ԂŁA
- �Q�{�̉��S�`���[�u�̃L���b�v�ɖڈ� A or B��t�L�B ���ꂼ��̃`���[�u��2ml�̍זE�t���B
- �Q�{���ɉ��S�����i6500rpm 10�b�j���A�㐟�݂��̂Ă�B�@
- �����I�h���u�^�b�s���O�v��20���������ɁA���ꂼ���1ml�̔|�{�t�iB-Med�j�������A�X�ɁA�s�y�b�e�B���O10��i�T��x�Q�Z�b�g�j�B���̑���ɂ��Q�{�Z�x�i�Z�k�j�̍זE�t1ml��2�{������B�@
- �`���[�uA��0.5ml���`���[�uB�Ɉڂ��B�`���[�uA�ɔ|�n�iB-Med�j��0.5ml������B���̌��ʁA�`���[�uA�͓��{�Z�x�ʼnt��1.0ml�A�`���[�uB�͂Q�{�Z�x�ʼnt��1.5ml�ɂȂ�B�@
�ȏ�ɂ��S�l���̏\���ʂ̎���A.B�̍זE�t�𐮂��B
�R�����g�F �H���i�P�j�u�J�o�[�K���X�̏����v�͎���A,B�Ƃ��Ɏ��{���Ƃ͕ʓ��Ɏ��O�����Ƃ��čs���A���{���i�זE�o�b�O�̊J�����j�̊w�K���Ԃ̊m�ۂɓw�߂Ă��������B
2a. �����ޗ��ꗗ�E����E�|�C���g�i�����t���͎���B�p�j
�@���L�̉ӏ������́A�{�����iA, B�j�ɗp����ޗ��̉���ł����A�����w�K�ɂ����邻���̈Ӗ��Ӌ`�ɂ��ẮA�\���i�v�f�̔z�u�Ƃ��̌q����j�Ƃ����������_�Ɋ�Â��A���Ɂu�E�F�u���������w/�זE�|�{�����̎�u�҂ցF��������ƌ����v�ɋL�ڂ����̂ŁA�����ł͎����w�K���v����{���鎞�ɎQ�l�ƂȂ�����L�q���܂��B���L�̍ޗ���p�������R(�o��)�A�����̃|�C���g�A�⑫(���̑�)�A�̂R�敪����{�Ƃ��Ă��܂��B
�@�Ȃ��A�{�����ł̓J�o�[�K���X��p�����זE�|�{�@���Љ�Ă��܂����A��ʓI�ȍזE�|�{�Z�p����l����i�̌o���҂Ȃ�j�A�����Ȏg���̂Ă̔|�{�V���[���i�f�B�b�V���j�ł��ǂ��̂ł́H�Ƃ������^���������̂ŁA�ȉ��Ɋȗ��ȃR�����g��t�L���܂��B�������A�{������|�{�V���[���ȂLj�ʓI�Ȕ|�{�Z�p�△�ۑ���Ȃǂōs�����Ƃ͉\�ł���K�ł��邱�Ƃ������ł��B
�@�܂�A�{�����i�{�V�X�e���j�̓����́A���H�w�K�̏�i�����w�K�j�̌���E����ɑΉ������邽�߁A�v���E�ȕցE�m���E��R�X�g�̂S���ڂ�O���Ƃ��ĊJ������Ă��܂��i�ȃG�l�E���S�ɂ��z�����Ă��܂��E�K�v�ł��j�B
�@�Ⴆ�A�����̎�u�҂��Ώۂ̏ꍇ�A�P��50�~���x�̔|�{�V���[���ł������҂�ʂƂ�����̕K�v�o��͂���قLj����ł͂Ȃ��A�܂��g�p����|�n�Ȃǂ̗ʂ�����Ȃ�ɑ����Ƃ����̂�����ł��B�܂�A�J�o�[�K���X�Ȃ��1/3�̒l�i�A�|�n�̕K�v�ʂ�1/10���x�Ƃ������Ƃ���uCG�|�{�@�v���Ă��Ă��܂��B�X�ɁA�{�҂ł͉�����Ă��܂��ACG�|�{�@�����̂܂܃p�b�L���O�𗘗p�������w�|�{�@�ɕς���u�זE�̃��C�u�ώ@�i�[��-�������ώ@���j�v���w�K�������ʼn\�ł���A���W�I�Ȏ��g�݂�ۑ茤���Ȃǂɂ��g����A�Ƃ������Ƃ����R�ł��B�܂��A�}�C�N���P�~�X�g���[�̂悤�ɁA�v���E�ȕցE�m���E��R�X�g�ɉ����A�ȃG�l�i�p�����̍팸�j�͍����̎��H�w�K�̏�ɂ����Ă���Ƃ������Ƃ��O���Ƃ��Ă��܂��B
A.���E�@���D :�ޗ��̎ʐ^�E�C���[�W�́u�R�R�v
��1�j �J�o�[�K���X�iCG�F 24x40mm NEO MATUNAMU #C024401�j�A
��2)�@���`���Z�����[�X(MC)�����ς݂̃J�o�[�K���X�iMC/CG ���쒲���j�A
��3)�@�ʏ�̃X���C�h�K���X�iSG: 76x26mm�j�A�@
��4�j �p���t�B���F���M�iPFP�F TOMBO �������F���M2285�j�A�@
��5�j �����ʉ��S�����@�i6500rpm���x��10�b�j
�@�@�@ ���邢�́A�ʏ�̉��S�����@�i1800rpm x 80�b���\�ȋ@��j�A
�@�@�@ ����ŁFFig11-13�Ȃǂ��Q�ƁB�@
��6�j ���S�`���[�u�i���ʉ��S�̏ꍇ��2ml�e�ʁj�A�@
��7�j �h���R���X�|�C�g�i�ŋۍς݁j�A�@
��8�j �Ȗ_�i�^�~���N���t�g�Ȗ_�F87106�j�A ���邢�͐H�p�́u�|���v
��9�j �w�K�������A�@
��10�j �g�уJ����
���̑��F��11�j35mm�|�{�V���[���A
B.����E�n�t. �F�ޗ��̎ʐ^�E�C���[�W�́u�R�R�v
��1�j �t�B�����o�b�O�זE�iFB�זE�@���������V�|�{�n�̋��ލזE�jFHLS�A
��2�j �t�̔|�n/�|�{�t�iB-Med�@Waymouth’s MB 752/1 Ca-Free�j�A
��3�j �Œ�t�iG-Fix �O���^���A���f�q�h�n�j�A���邢�́i�|�_�G�^�m�[���n�F�w�K�����p�j
��4)�@���F�t�iCV �N���X�^���o�C�I���b�g�j�A�@
��5)�@�[���`���t�iGel�j
��6�j �K�v�ɉ��������`���Z�����[�X�t�iMC�j�A
��7�j �����iGel�����p�j�A�@
���� ���̑��i�K�v�ɉ����ėp����j�F
��8�j�������iDW�j�A
��9�j�����_�ɏՐH����/Ca�t���[�iPBS-�j�A
��10�j70%�G�^�m�[�����i70%EtOH�j�A
��11�j�[���`���A
C.���i�Ȃǁ@�F�ޗ��̎ʐ^�E�C���[�W�́u�R�R�v
��1�jCG�X���C�h�K���X�̐Òu�p���^�g���[�i����10cm�V���[���j�A
��2�j�X�R�b�`�����f�B���O�e�[�v�A
��3�j�n�T�~�A
��4�j���������y���A
��5�j���x�v�A
��6) �^�C�}�[�A
��7�@���R�b�v�i���^�E�V�i�j�A���邢�͓����v���J�b�v�A
��8�j�I�����i��^���b�V���[�j�A
��9�j���i�v�L���A
��10�j50ml�r�[�J�[�A
��11�j���^�s���Z�b�g�A
��12�j���S�`���[�u�p�X�^���h�A
��13�j��@�A
��14�j�S�~�܁A
��15�j�����E���o�b�g�A
��16�j������͉��x�K�v�B
D. �{�����ŗ��p�ȕ֗��O�b�Y�i�K���i�j�F�ޗ��̎ʐ^�E�C���[�W�́u�R�R�v
�@
�F���R�b�v�iC7�Q�Ɓj�A���i�v�L���iC9�Q�Ɓj�A�h���R���X�|�C�g�iA7�Q�Ɓj
���ޗ�����FA. ���E�@�큄
A. ���E�@��̉���D
��1�j �J�o�[�K���X�iCG�F 24x40mm NEO MATUNAMI #C024401�j
�ړI/���R. �w��̃J�o�[�K���X�i��]�_�K���X�j�͓s���悭�����זE�̐ڒ������ɓK���������ł��邽�߁i�|�{��FCG�\�ʂ̓v���X�d�ׂ̏�Ԃ������A�זE�\�ʂ͓��`���Ȃǂɂ��}�C�i�X�d�ׂ̂��߁A�d�C�I�����̌����Ɋ�Â������ڒ������������Ȃ��i�s�j�B���l�ȕ�����������ʓI�ȍזE�|�{�p�|���X�`�����|�{�V���[���Ȃǂɔ�ׂ��̃R�X�g��1/3���x�B�w�K�������ɂ��W�{�ώ@�ɂ��K���Ă���B �|�C���g. CG�ɐG�鎞�͂��̕Ӊ��E�O���ň����|�{�ɗp��������͕s�p�ӂɐG��Ȃ��B��舵���ɕs����ȏꍇ�̓X�R�b�`�e�[�v�◼�ʃe�[�u���J�o�[�K���X�̊p�Ɍy���������āu�P���ނ�v���s���B�����Ȃ̂ō����Ȃǂ�w�i�Ƃ��Ď��ʂ�e�Ղɂ���B �⑫. �ʏ�̃X���C�h�K���X�i�\�[�_�ΊD�K���X�F�j�͑e�G�H�ȑg���ɂ�鐻���i�ł���A�����ł͂��邪�A���̂܂܂ł͍זE�Ő��������זE�̐ڒ�������זE�|�{�ɓK���Ȃ��B���萻�i�iNEO�K���X�j�͒���t���i���������������Ȃ��j�h�~�������Ȃ���Ă��邽�߃X�g���X�̂Ȃ��������\�ł���A���̗p�r���L���i����������i�̈����ł��낤�j�B �@[���X�gA]�֖߂�B
��2) ���`���Z�����[�X(MC)�����ς݂̃J�o�[�K���X�iMC/CG�j�F����B�p
�ړI/���R. OEKAKI�����ɗp���邪�A����A�Ɠ����ގ��i�|�{��j�ɂ��זE�|�{�����i����B�j���v�悷�邽�߁B0.025%MC�n�t�Ɉ�ӈȏ�Z�Ќ�ɐ���E���������J�o�[�K���X�iMC/CG�F���̌��ʁA�זE�͐ڒ��L�W���ł��Ȃ��Ȃ�j�B�@�|�C���g. ���`���Z�����[�X�̈Ӌ`�́uWeb��������ƌ����v���Q�ƁB�A���A���̗R�������u�����A���u�~���v�̈����ȑ�p�i�Ƃ��Ďg�p�������Ƃɂ͗��ӁB�⑫. MC/CG�͎�����\�B�ʏ�̃|���X�`�������̔|�{�V���[���̏ꍇ�AMC�����͐��b�Ŋ�������i�ڒ��h�~�ɂȂ�j���A�J�o�[�K���X�ł͂��Ȃ蒷���������Ԃ�K�v�Ƃ���B�Ȃ��A�X���C�h�K���X�i�\�[�_�K���X�j�́i���j��ڒ����̍ގ��ł���A����B�̗p�r�Ɏg����̂ł͂Ƃ������ӌ������邪�A�����y���ɂ��ڈ�A�p���t�B���F���M�̃T�[�N���A�܂��h���[���`���Ȃǂ��|�{����Œ���F���ɔ�������ꍇ������̂œK���ł͂Ȃ��B �@[���X�gA]�֖߂�B
��3) �ʏ�̃X���C�h�K���X�iSG: 76x26mm�j
�ړI/���R.�J�o�[�K���X�̎x����ՂƐ��F�W�{�̊ώ@��Ղł���B�|�C���g. �x����ՂȂ̂ŁA�H������Ɏx�Ⴊ�Ȃ��ꍇ�͎����l�b�g��v���X�`�b�N���ɂ���p���\�B�@�⑫.���ɂ��ė��p���\�B �@[���X�gA]�֖߂�B
��4�j �p���t�B���F���M�iPFP�F�@TOMBO �������F���M2285�j
�ړI/���R. �������̉t�~�߃T�[�N���i��`���j�ɂ��CG�ɓH�������n�t�́u�t�~�߂ƎR����v���\�Ƃ���B�p���t�B���E���E�\�N�Ȃǂł���p�͉\�ł��邪�A�F�t���y����CG�̎��ʂ�e�Ղɂ���B�@�|�C���g. �{���i�Łu�`���v���J��Ԃ��ƃp���t�B���u�N�Y�v���t������̂ł��̎��͎��i�v�L���Ő@�����B������͉�����ԂŎg�p����ƂȂ߂炩�ɕ`����B�@�⑫.�u�`���v�͕����I�Ȉ��͂ł���A�x�����SG��ōs��Ȃ���CG�������̂Œ��ӁB���F���Z�����ɂ��t�~�߃T�[�N�����\�i�͌��ʓI�j�ł��邪�A�x�g�x�^�Ȗ{�i��CG�W�{�̊Ǘ��ɓ�_�������B �@[���X�gA]�֖߂�B
��5�j �����ʉ��S�����@�i6500rpm���x��10�b�j
�@�@�@�@
���邢�́A�ʏ퉓�S�����@�i1800rpm x 80�b�j
�ړI/���R.�t�B�����o�b�O�זE�͐Òu���V��Ԃ̂���Ready-To-Use���\�Ƃ��邪�A�זE�^���i�`�ԕω��j�������E�v���ɔ������邽�߂ɂ́A��ʓI�ȓ����|�{�זE�Ɠ��l�ɁA�זE�\�ʂɕt�������S�~�̂悤�Ȕ��ׂ͚�G������菜���i�זE���j���K�v�ł���B�H��2�u�זE�t�̒����F���S�ĕ��V�v�͂��̖�����S���B���̑�����ȗ�����CG�|�{���s���Ă����\�����x�ł͍זE�^���͐����Ȃ��i���҂ł��Ȃ��j�B�]���āA�u�㐟�݁v���c�������܂܍ĕ��V����Ɠ��l�Ȍ��ʂɂȂ��Ă��܂��B�{���Ɋւ��H������ɂ͒��ӁE�z�����K�v�ł���B
�@�����זE�̉��S�����͒ʏ킻�̃_���[�W���l����1000rpm(����)���x�ŏ������邪�A�v���ȕւ̂��ߕX�I��6500rpm���x�̔��ʉ��S�@�𗘗p����B�����͑��x�Œ�ł���̂ŁA�������ʂ���10�b���x�Ȃ�זE�Ƀ_���[�W��^���邱�ƂȂ��v���ȕւɍזE�̍ĕ��V���\�Ƃ����o�܂���B�@�|�C���g.���̉��S����(6500rpm 10�b)�͈�ʓI�Ɍ����Δ�펯�ł���A�Ⴆ�A���\�b�ȏ�6500rpm�ʼn��S����זE�Ƀ_���[�W��������̂Œ��ӁB�@�⑫. ���S�@����i�Ƃ��ċ�����鍂�Z�������͂���قǑ����Ȃ��B���̏ꍇ�݂͑��o���őΉ����Ă��邪�A���}�̂悤�Ȉ����Ȏ�����\�ł���i����ɂ��Ă͌ʂ̎���Ƃ��đΉ�����j�B �@[���X�gA]�֖߂�B
�@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.10 �@�@�� Fig.11 �@�@�E Fig.12)
���艓�S�@
���擪�s�ֈړ��E�ڎ�����
��6�j ���S�`���[�u�i���ʉ��S�̏ꍇ��2ml�e�ʁj
�ړI/���R.�@��L�T�j�̔��ʉ��S�@�ɑΉ������K�i�`���[�u�i�Qml�e�ʁj���g�p����B�@�|�C���g.���S��]�̎��͑Ίp������o�����X�d�ʂƂ���i�قډt�ʂ���������Ύx��͂Ȃ��j�B�@�⑫.1.5ml�K�i�`���[�u�ł��\�ł��邪�A2ml�`���[�u�̓X�g���X�̂Ȃ��זE�t�̈������\�ɂ���B�`���[�u�L���b�v�̊J�i�n���h�����O�j�͗���w�ɂ��m���ȃn���h�����O�ōs���B �@[���X�gA]�֖߂�B
��7�j �h���R���X�|�C�g�i�ŋۍς݁FCC2000�j
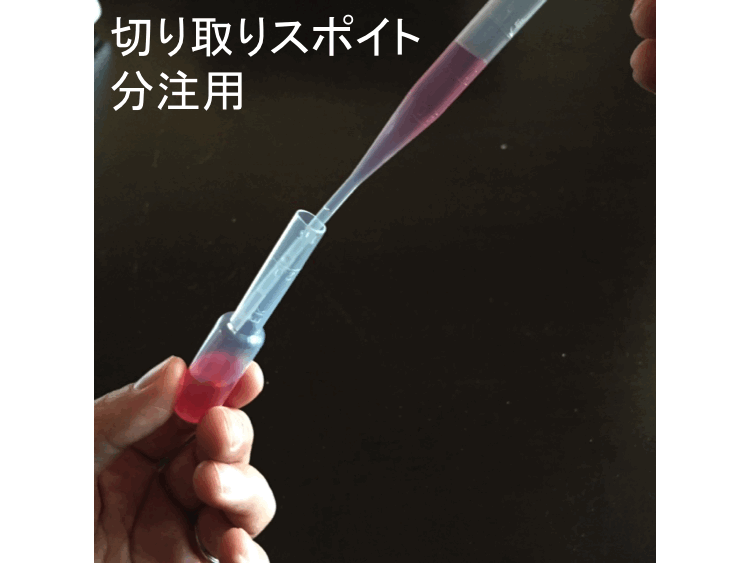
�ړI/���R.�@�����ɓK�����K�i/�e�ʂƎw���o�Ƀt�B�b�g�����D�ǐ��i�ł��邽�߁B�܂��A�X�|�C�g�������i����j��2.0���x�����n�T�~�Őؒf����u����ɂ�鏬�����ǁF��p�������v�Ȃǂɑ��ς�肵�A�n�t������z�z�p�ȂǂɎg�p�ł���̗D����́B�@�z���ʂ͉t�ʍ���i�������j�ōő�3.0ml�A�ŋۍςݓ����|���v���s�������X�|�C�g�B�@�H���ʂP�H��0.05ml�Ƃ݂Ȃ��B�@�|�C���g. �����H���̃X�|�C�g����̑O�ɂ͍������i�t�ʁj�⊴�G�̊m�F�i���K�j���K�v�i���ʑ���ł��邽�߁u�x�_�E�͓_�E��p�_�v���ӎ��������葀��ɓw�߂�j�B�|���s���O�͂R�{�w�B�@�⑫. �{�i�͂P�{18�~���x�ł��邪�Đ����e�ՁB�u����DW�������v���X�|�C�g����i�|���s���O�j�ŊȒP�ɍs����̂ōĐ����p�i�ȃG�l�j�͐��������B���̑��̕��i�ɂ��Ă����l�i���S�`���[�u�Ȃǂ��Đ��ė��p�j�B
�@ �Ȃ��A�S�l�P�O���[�v�i�ǁj�̋��ގ����̏ꍇ�A�X�|�C�g�̕K�v���͎��ɐ��S�{�ȏ�̂��Ƃ�����A��R�X�g���̂��߂ɂ͍H�v���K�v�ł���B10�Ljȏ�̏ꍇ�͂��Ў��O���c���s���܂��傤�B�@[���X�gA]�֖߂�B
�@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.19 �@�@�� Fig.20 �@�@�E Fig.21�j
���擪�s�ֈړ��E�ڎ�����
��8�j�@�Ȗ_�i�^�~���N���t�g�Ȗ_�F87106�j�E���邢�́u�|���v�F����B�p
�ړI/���R.�@����B�i���G�`�������j�̍H��1�u�[���`���t���J�o�[�K���X�ɓh��i�h���j�v�Ɏg�p���邪�A�t���Z�����Ă���[���c�����Ȃ��N���t�g�Ȗ_�i�w��i�j���œK�ł���B�@�|�C���g. �{�i�Ȗ_�̐�[�ɏ��ʂ̃[���`����t����Ώ\���ʂ��Z������̂ŁA��[�Ɏ��i�v�L����t���A�]�t�͏����g�p����i�\�������邭�炢�����Ă����v�F�זE�ɂ͌������I�j�B�[���`���h���͏d�v�ȍH���ł�����h��͌��ցB���̗��R�͌��h�芣���������h���[���`���ōזE�|�{���s���ƁA�����[���`�����z���E�c�����A�זE���ڒ��L�W������ɃJ�o�[�K���X���甍�����邽�߁B�c�_���h���R���X�|�C�g�̐�[�ɍ������ނƈ��肵�Ďg�p���\�B�@�⑫. �t�F���g���H�ւ��c�iCOPIC�F�f�U�C���y���j���L���ł��邪�A��R�X�g�ɂ͖{�i�i�^�~���Ȗ_�j���K���ł���B
���⑫�F�Ȗ_�̑�ցu�H�p�|���v�̎g�p�@��
�P�j�|����[�̐��~�����u�ܐ�v�ŃJ�b�g����B �Q�j������ۂ��Ȃ�悤�ɃX���C�h�K���X�̏�����̊p���u�����t���E�������v�ۂ�����i�K�{�j�B �R�j�n���[���`���t�ɒ|���𐔕��ȏ�Ђ��u���ɂ���B �S�j�`��(�h��)�̑O�ɂ́A�|�����w�ŕێ����A���̌y���X�i�b�v�Łu��[�̗]���ȉt���U�v������B �T�j�C�ӂ̊G������`���B�A���A�������A�����M���ŕ`���B������h��t���c��̂Ō`��������͂��B �U�j�h��t�����R�����Ō����Ȃ��Ȃ�����A����30���ȏ�Ŋ��S�Ɋ���������B�@[���X�gA]�֖߂�B
��9�j �w�K�������i�����쐳���������j
�ړI/���R.�@���F�W�{�̌������ώ@�p�B�t�B�����o�b�O��Òu�����̂܂܍זE�ώ@�i�����j���\�B�@�|�C���g. ���ʂ͑��߁A�V�{�����߂Ŋώ@����B�R���f���T�[���t������@��ł́A�V�{���͊J���A���ʂ͂ł��邾���������A�R���f���T�[�̍������߂Ŗ��ĂȊώ@���ɓw�߂�B�@�⑫. �����F���זE�̊ώ@�ɂ͈ʑ������u�t���|�����������K���Ă��邪�A�ʏ�̊w�Z�������ʼn\�i���wCG�|�{�@��p����F���@�͕ʎ��Q�Ɓj�B�܂�A�����X�Ζ@���s���[�����������Ƃ��Ċώ@���\�ł��胉�C�u�ώ@���\�ƂȂ�B�]���āA�{�����̔��W�W�J�Ƃ��čזE�������̊ώ@���\�ł���i�w�Z����̒ʏ팰�����ł��\���ɉ\�F�ڍׂ͕ʎ��Q�Ɓj�B �@[���X�gA]�֖߂�B
��10�j �g�сi�d�b�j�J���� �iFig22�j
�ړI/���R.�@���݂̌g�ѓd�b�̃J�����𑜓x�͂��Ȃ�D��Ă���̂Ō������ώ@���̎B�e�ɗp����B�@�|�C���g.��U�ꂵ�Ȃ��悤�Ɏx�_�E�͓_�E��p�_�ɔz���i�H�v�j����B�@�⑫. �ʏ팰�����̐ڊ���Y�̊O�a��φ30mm�Ȃ̂ŁA�g�ѓd�b�P�[�X�̃J���������Y���ɓ��a30mm��̃p�C�v�Ȃ��iYAZAKI:J-113�j��ڒ�����ƃJ�����z���_�[�Ƃ��Ďg�p���\�i�ڍׂ͕ʎ��Q�Ɓj�B �@[���X�gA]�֖߂�B
��11�j35mm�|�{�V���[���A
���擪�s�ֈړ��E�ڎ�����
���ޗ�����FB. ����E�n�t��
B. ����E�n�t�̉��.
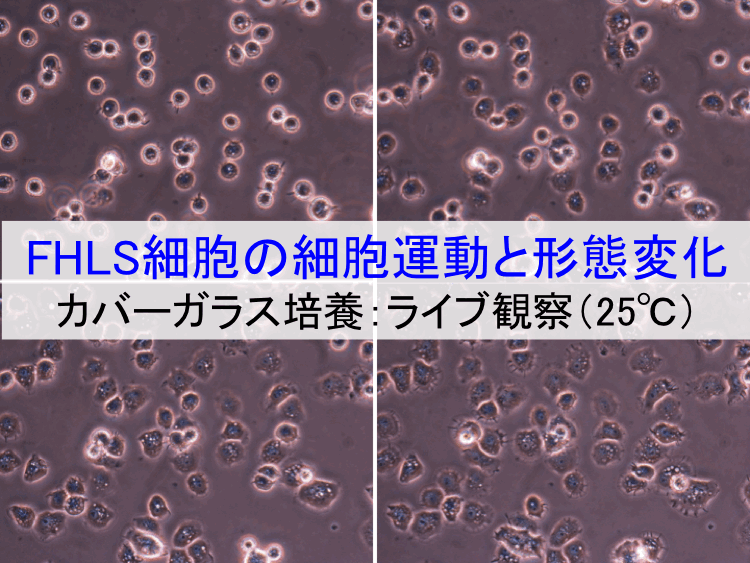
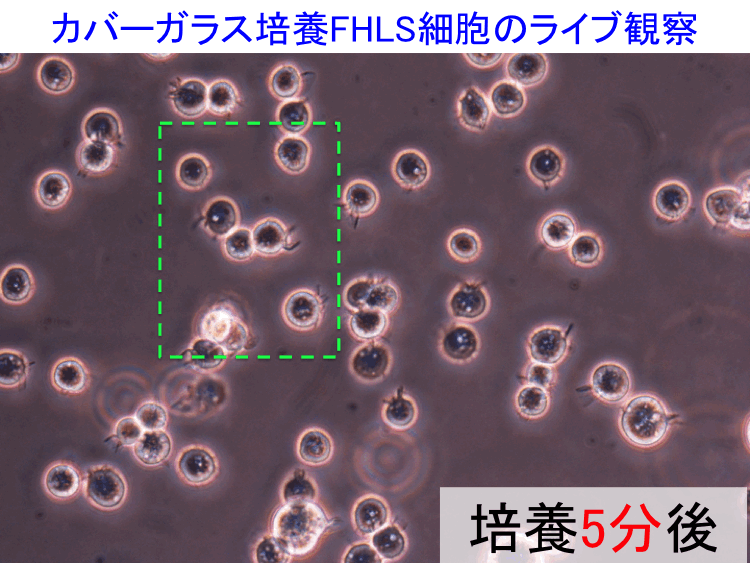
��1�j �t�B�����o�b�O�זE�iFB�זE�@���������V�|�{�n�̋���FHLS�זE�j
�ړI/���R.�@�זE�����S�ɕ��V���U��ԂŗA�����A���̂܂܍זE�����Ɏg����Ƃ���|�{�Z�p�͂��Ȃ����I�ł��邪�AFHLS�זE���t�B�����o�b�O�i�|���G�`�����܁F��ڒ����E�K�X���ߐ��j�Ɏ��e�����ꍇ�͉\�ł���i���̏ڍׂ͓��ɕ��G�Ȃ̂ł����ł͏ȗ��j�B�@
�|�C���g.
(1) �זE�͖��ۑ���ɂ��t�B�����o�b�O�זE�iFB�זE�j�Ƃ��Ă���B�s�p�ӂȊJ���̓R���^�~�l�[�V�����������N�������߁A���̊J���͎������{���ɍs���B
(2) FB�זE������́A�����ŕ��u���Òu��Ԃŕۊǂ��A���Ɉ�x�A�����U����^���זE�U��Ԃɂ���i�זE�͎����I�ɏ��X�ɋÏW����̂ŕ��U������F�d�v�j�B
(3) �K���i�Ǘ����x�j��20-30���Ƃ��邪�A�����|�{�ł͐v���ȍזE�^�������҂��邽�߁A����A�ł�28�����x���K���Ă���i20�������̏ꍇ�A�זE�^�����x�͂��Ȃ�x���Ȃ�j�B
(4) ����FB�זE��80���זE/ml���x�Œ�������邪�A����̕ۑ��E�ۊǒ����זE�͊ɂ₩�ɑ��B����B�L�������͍זE�̑��t�ɍ��킹�Ēʒm���邪�A�P�T�Ԉȏ�̗L�������̐ݒ�ɂ͓��ʂȁi��������I�ȁj�����Ǘ����K�v�ƂȂ�̂ŁA���w�҂̏ꍇ�͎���A5�����x�ƍl���ė~�����B�ڍׂ͕����̃��N�G�X�g���̊m�F�������Q�ƁB
(5) �J�������זE�o�b�O�͊J������܂�Ȃ������t���V�[���ɓ��B���Ȃ���ԂƂ���i�V�[���ɓ��B����ƍזE�t�͎��R�ɟ��ݏo��̂Œ��Ӂj�B
(6)������O�̘b�ł͂��邪�A�t�B�����o�b�O���ɂ͐����Ă���זE�������Ă���̂ŕs�p�ӂɃo�b�O�������Ԃ��Ȃ����ƁB�@�@
�⑫. �זE�t�i�|�{�t�j�͎��̊�b�|�n�Ƀ��N�g�A���u�~����������K�ʓY���������́B�זE�̓t�B�����o�b�O���ł͐Òu���V��Ԃł��苅��ł��邪�A����A,B�̂悤�ɓK�Ȕ|�{��i�ڒ���j�ɍזE���ڂ���ƍזE�͎����I�ɐڒ����זE�^�����J�n����B���̊�{�I�Ȑ����ɏ]���{�זE�����͐��藧���Ă���B �@[���X�gB]�֖߂�B�����Òu�ŊǗ��A�ÏW�h�~�̂��ߐ����U�����P��A�����ۑ��A�J���͎��������A
��2�j �t�̔|�n/�|�{�t�iB-Med Waymouth’s MB 752/1 Ca-Free�j
�ړI/���R.�@�{�҂̎����w�K�ɗp����זEFHLS�̊J���ɗp������b�|�n�ł���Òu�ڒ��|�{�ɂ��K���Ă��邽�߁B���̔|�n�͎��ƒ����ł���o��팸�ɑ傫���v�����Ă���i�����ϑ������|�n�͋����قǍ��z�j�B�E�F�C�}�X�������E�J�������{�|�n�́u���m�̉��w���������݂̂ɂ�閳�������^���p�N�|�n�Ƃ��ĊJ�����ꂽ�͂��߂Ĕ|�n�v�A������40��ނ��炢�B�|�C���g.����A,B�Ɏg�p����{�|�n�͖������E���^���p�N��Ԃł���B�@�⑫. pH��HEPES�ɏՌn�A�R�������̓J�i�}�C�V�����g�p�B�|�n�̕ۑ��͎����ł��\��Ȃ��B�s�̂���Ă���J���V�E���s�ܔ|�n��p���Ă��{�����͐��藧�͂��B �@[���X�gB]�֖߂�B
��3�j �Œ�t�iG-Fix �O���^���A���f�q�h�n�j �E�A�w�ґΏۂł��u�|�_�G�^�m�[���n�v
�ړI/���R.�@�זE�̔��\�����Œ肷�邽�߁i�Œ�\�͂������O���^���A���f�q�h���听���Ƃ���Œ�t�j�B�@�|�C���g.�X�N���[�X�Y�������ɂ�铙���z���}�����Œ�̏ꍇ�ł��זE���̓u���b�u���`�����邪�A�{�Œ�t�ł͌`������Ȃ��B�Œ�t�͊댯�t�Ƃ݂Ȃ����̎�舵���ɂ͏\�����ӂ���B�A�w�҂��p����ꍇ�͎w���҂̓K�Ȏw���Ɣz���͏d�v�i���L�̐��F�t�ł����l�j�B�@�⑫. �ʏ�A�{�Œ�t�͎g�p�Z�x�Œ���邪�A�K�v�ʂ������ꍇ��5�{�Z�x�i�Z�k�t�j�Œ���ꍇ������B���̏ꍇ�͒S���҂��������i�������j�œ��{�Ɋ�߂��Ďg�p����B�����ۑ��B �Ȃ��ACG�|�{�זE�̌Œ菈���̎��Ԃ͐v�����|�Ƃ��邽��2���Ƃ������A�������Ԃ��ݒ肵�Ă��x��͐����Ȃ��B
�d�v�F�w�Z�Ȃǂɂ�����A�w�҂�ΏۂƂ�������w�K�̏ꍇ�����S�����K�{�ł��邽�߁u��z���}�����n�F�|�_�G�^�m�[���n�v�̌Œ�t�����E�p����i��w�Ȃǂɂ��Ă����S�ł��邪�A����ł��Œ�t�͈��S����͕K�{�ł���j�B �@[���X�gB]�֖߂�B
��4) ���F�t�iCV �N���X�^���o�C�I���b�g�j
�ړI/���R.�@�ėp�������������I�ɍזE���F���\�Ȃ��߁B�g�p�Z�x��0.25mg/ml�i�G�^�m�[�������t�j�B�@�|�C���g.��L�̌Œ�t�Ɠ��l�ɂ��̎�舵���ɂ͒��ӂ���B�s�p�ӂȃX�|�C�g����i�|���s���O�Ȃǁj�ɂ���U�������Ȃ��悤�ɒ��ӁB�����w�ɕt�������ꍇ�͐���E�Ό��őΉ����邪�A�c��ꍇ�͂��̒E�F��70%EtOH��p����B���邢�͐�����ɂ͎��R�E�F����͂��B�@�⑫. �g�p�ʂ������ꍇ�́A�Œ�t�Ɠ��l�ɁA�Z�k�t�i�S�{�Z�x�j�Œ���ꍇ������B���̏ꍇ�͒S���҂��������i�������j�œ��{�Ɋ�߂��Ďg�p����B�����ۑ��B�Ȃ��A�Œ�t�Ɠ��l�ɁACG�|�{�זE�̐��F�����̎��Ԃ�3���Ƃ������A�������Ԃ��ݒ肵�Ă��x��͐����Ȃ��B �@[���X�gB]�֖߂�B
��5) �[���`���t�iGel�j�F����B�p�@
�ړI/���R.�@����B�͎�v�Ȑ��̗R��������p�����������|�Ƃ��Ă���B���̈���R���[�Q���i�\�����^���p�N���Ƃ��Ă��ł��ܗʂ������j�B�{�����ł͂��̕ϐ������u�[���`���F�H�p�̔[���`��:��m���Ɓv��p���Ă���B1%�̐��n�t�B�@�|�C���g.�ቷ�E�����ł��Q����������̂�Step1�ł͉����n����̗n�t��ԂŁuMC/CG�̃[���`���h���v�ɗp����B�@�⑫.�ۑ��͎����ł��\��Ȃ��B �@[���X�gB]�֖߂�B
��6�j ���`���Z�����[�X�t�iMC�j�F����B�p�i�K�v�ɉ����āj
�ړI/���R.�@����B�̑ΏƎ������K�v�ȏꍇ�Ɍ���������t�B���邢��MC/CG�����삷��ꍇ�ɕK�v�B0.025%���n�t�Ŏg�p�B�@�|�C���g.MC�͉t���^���p�N���ōő�ܗʂ̌����A���u�~���̑�֕i�Ƃ��Ďg�p���Ă��邪�A���̗��R�́A�����A���u�~���Ɠ��l�ɍזE�ڒ���j�Q������ʂ����邽�߁A�܂��A����u�����A���u�~���v�͏��������ł��芎���s���₷�����߁B�@�⑫. �K�v�ȏꍇ�͂��̎|��ʒm����B���̏ꍇ�A20�{�Z�x�i�Z�k�t�j�ő�����\�Ȃ̂ŏ������ȂǂŊ�߂��p����B�����ۑ��B �@[���X�gB]�֖߂�B
��7�j Gel�����p�������F����B�p
�ړI/���R.�@����B�H���P�̃[���`���h���ɗp����[���`���t�̉����n��p�B�@�|�C���g.�Ώ����Ȃ��łˁB�@�⑫. ������́A���R�b�v��30�x���x�̂��������A���̏�Ŕ|�{�������s���ɂ��K���Ă���B �@[���X�gB]�֖߂�B
��8�j �K�v�ɉ������������i������DW�j
�ړI/���R.�@�Z�k�t�̊�߂ɗp����B���邢�̓X�|�C�g�����X�|�C�g�̍Đ��p�B
��9�j �����_�ɏՐH�����iPBS-�FCa�t���[�j:�K�v�ɉ�����
���R.�|�{����Œ�O�̍זE���Ȃǂɗp����B�@�|�C���g.���\�����x�Ȃ�|�n�̑�ւƂ��Ďg�p���邱�Ƃ��\�B�@�⑫. 12.5�{�Z�x�̔Z�k�t�Œi�g�p����4mlPBS-/46mlDW�Ŋ�߁j�B �@[���X�gB]�֖߂�B
��10�j 70%�G�^�m�[�����i70%EtOH�j:�K�v�ɉ�����
�ړI/���R.�@�{�����͖��ۑ���ɂƂ��ꂸ�s�����A�t�B�����o�b�O���J���i�o���V�[���̐���j�̎��́A����O�ɂ��̕�����w����G�^�m�[�����Łi70%EtOH��H���������i�v�L���ŏ��Łj���Ă���s���ƃR���^�~�l�[�V�����̊m�������Ȃ艺����͂��B�@�|�C���g. 70%EtOH�͉R���ł���̂ʼn̑��ň����Ă͂����Ȃ��B�e��ɂ͉C���ւ̕\�����K�v�B�@ �@[���X�gB]�֖߂�B
���擪�s�ֈړ��E�ڎ�����
���ޗ�����FC. ���i��
C. ���i�̉��.�@
��1�j CG�X���C�h�K���X�̐Òu�p���^�g���[�i����10cm�V���[���j
�ړI/���R. �@��u�҂̎���i�s���̂��Ƃ�������j�ւ̑�BCG�X���C�h�K���X�̃n���h�����O���m���ɂȂ邽�߁B�@�|�C���g. ���i�v�L����~���Ďg�p����B�Œ���F����̎������S����̂��ߎg�p����B �@[���X�gC]�֖߂�B
��2�j �X�R�b�`�����f�B���O�e�[�v ���邢�́A������u�{���e�[�v�F�����̗v
�ړI/���R.�@�X�R�b�`�e�[�v�@�Ƃ����h�z�����̐ڒ������@�����邪�A�X�R�b�`�e�[�v�͂Ƃ������g���₷���������i�B���Z����Ǝ��R�ɔ�����₷���Ȃ�B���M�������\�B�܂��A�J�o�[�K���X�́u�ꖇ�ނ�v�ɂ��K���Ă���B�@�|�C���g.�p���鎞�͔������Ղ����邽�ߊp��Z�ӂ�܂�d�˂āu�܂݁v�����g�p�B �@[���X�gC]�֖߂�B
��3�j �n�T�~
�ړI/���R.�@�זE�̃t�B�����o�b�O�J�����͔M�n���ɂ��V�[������Ă���̂ł��̐���Ɏg���B�@�|�C���g.�{�����ł͖��ۑ���ɖ��ڒ��ōs�����A�\�s���K�ȂǂŐ����A�����ē���זE�o�b�O���g�p����ꍇ�́A�o�b�O�J������n�T�~��70%EtOH�ŏ��ł�����J������͕K�v�ł��낤�B�Ȃ��A�t�B�����o�b�O�̃W�b�v�V�[���̊J���̎��͎w���o�b�O���ɓ���Ă͂����Ȃ��B�Q�{�w�ŃW�b�v�V�[�������݃X���C�h�����J��������B �@[���X�gC]�֖߂�B
��4�j ���������y��
�ړI/���R.�@��������i�B�J�o�[�K���X�K���X�ʂɏ����Ă��F���Œ�����i���̐��i��p����B �@[���X�gC]�֖߂�B
��5�j ���x�v
�ړI/���R.�@�|�{���x�̊m�F�p�B�זE�͔|�{���x�Ɉˑ����čזE�^�����i�s���邽�߁B���{���Ԃ�����ꂽ�����w�K�̏ꍇ�ł͉��x�m�F�ƒ��߂��d�v�ł���B�@�|�C���g.�g���[�̏�ɒu���Ĕ|�{���x������ł��鏬�^�i�i�Ϗ܋��p�H�j�Ȃǂ��K���Ă���i���O�ɉ��x����K�v�j�B���邢�́A���˔M���x����@�i�ԊO�����x�v�j���ƂĂ��֗��ł��B �@[���X�gC]�֖߂�B
��6) �^�C�}�[
�ړI/���R.�@�|�{���Ԃ̊m�F�B�A���[���t�����K�v�B �@[���X�gC]�֖߂�B
��7) ���R�b�v�i���^�E�V�i�j�A���邢�������v���J�b�v
�ړI/���R.�@�����p�̎��R�b�v���邢�̓v���J�b�v�͑��ړI�Ɏg�p����B�{�����ł́A�p�t����A����X�|�C�g�̃X�^���h�A�n�t�����p�A�����p�A������̕ۉ��Ǘ��ȂǂƂ��ė��p����B��u�ґ����̎����w�K�ł́u�|�{�t�̔z�z�p�J�b�v�v��u�t�B�����o�b�O�זE�̈ꎞ���e�e��v�ȂǂƂ��Ă����p���\�ł���B�@�|�C���g.���L�W�j�̃I���������]�|�h�~��Ƃ��Ďg�p����B�n�t�̏ꍇ�͂��̏�ɗn�t�p�̃J�b�v���d�˓��ꂵ�ėp����B�@�⑫.�v���J�b�v�̏ꍇ�͐��A�ė��p�ɓw�߂�B�ȃG�l��R�X�g�͋��ގ����ł��K�v�B �@[���X�gC]�֖߂�B
��8�j �I�����i��^���b�V���[�j
�ړI/���R.�@�f�B�X�|�J�b�v�̓]�|�h�~�p�B��L�V�j�ɋL�����o�܂���B�@�|�C���g.�H��X�Ȃǂň��������b�V���[�ő�^��p����B �@[���X�gC]�֖߂�B
��9�j ���i�v�L��
�ړI/���R.�@�z�����������A���ʂ���A���^�I����L�����C�v�Ȃǂ��L���ň����Ȃ��߁BCG�K���X�̐Òu�≓�S��̏㐟�ݏ����ȂǂɌ��ʓI�B�@�|�C���g.�ȃG�l�F���̎g���߂���p���ɂ��K���Ă���B �@[���X�gC]�֖߂�B
��10�j 50ml�r�[�J�[
�ړI/���R.�@�t�B�����o�b�O�̊J���₻�̍זE�̃s�y�b�e�B���O�̎��ɗp����B���̌�̓X�����h�Ƃ��ėp����B���^�����v���J�b�v�ł��B �@[���X�gC]�֖߂�B
��11�j���^�s���Z�b�g
�ړI/���R.�@�Œ�E���F�̐���ȂǂŕK�v�ɉ����Ďg�p����B�@ �@[���X�gC]�֖߂�B
��12�j ���S�`���[�u�p�X�^���h
�ړI/���R.�@���ʉ��S�`���[�u�̈����ɕK�v�B�Ȃ��A�h��3���X�|�C�g�̃|���s���O����ؒf����`���[�u�X�^���h�ɑ��ς��B�܂��́A����(1.5cm���炢)�̂���㎿�Ȕ��A�X�`���[���ɃR���N�{�[���[�Ō��J���쐬����B�������͉̂����n��p�̃t���[�g�ɗp����B�@[���X�gC]�֖߂�B
��13�j ��@�F����B�p
�ړI/���R.�@�H��1�uMC/CG�Ƀ[���`���h���v�̌�́A10�����x���R���������邪�A���̌�͐�@�ȂǂŊ��S�Ɋ���������A�͎���B�̏d�v�ȃ|�C���g�B�@�|�C���g.���R������������Ȃ�������������ł��ǂ��B�h���C���[��z�b�g�v���[�g�̎g�p���B�������A�זE�t��H������O�ɂ́A�����ɖ߂��Ă�������Ɏg�p����i������ԂōזE�t��H������Ɠh���[���`������������A�זE�ɔM�_���[�W��������j�B�@�⑫. �H��1�����O�����Ƃ���ꍇ�́AGel�h����͂��̂܂����ۑ��Ŏ��R�����Ƃ���B
��14�j �S�~��
�ړI/���R.�@�g�����͎��R�H�F���ʔp���̂��߁B�@�|�C���g.���^�r�[�j�[���܂Ȃ�e�����e�[�u���Ƀe�[�v�~�߂��Ďg�p�B�@[���X�gC]�֖߂�B
��15�j �����E���o�b�g
���R.�Œ���F���s���ꏊ�Ƃ��̐����e��B�@�|�C���g.�R�A�̐����R�b�v�̏ꍇ�ł��Œ�t����F�t����ɕt�����ꍇ�̂��ߐ����ݔ��͕K�v�B �@[���X�gC]�֖߂�B
��16�j ������͉��x�K�v�B
�ړI/���R.�@�זE�͔|�{���x�Ɉˑ����זE�^����i�߂�B����A��Z���ԂŐv���ɍs�����߂ɂ́u28������33�����x�v�̉��x�ݒ肪�K�v�ł���B�������A35���ȏ�̐ݒ�͍זE�Ƀ_���[�W��������̂Œ��ӁB����B�̏ꍇ��25���ȏ�ł���Ώ\���ł���B
�@���̉����ۉ��Ƃ��ėe�Ղȕ��@�͂Q���d�˂̎��R�b�v��30-35���̂��������A���̏�ɔ����g���[�i�f�B�b�V���A���邢�͕��j��~���u�|�{��v�Ƃ��Ďg�p����B���邢�́A�@�P�j���R�b�v�⏬�^�̎����Ɏg���̂ăJ�C�������p����B�������A���x�Ǘ��ɒ��ӁB�@�Q�j�܂��͎����i�C�̔����x�j�ɃJ�C�������u���~���v���悹�|�{�ʂƂ���B�@�R�j�M�ы��p�̉��x���ߎ��p�l���q�[�^�[�ł��A�ȂǍH�v���čs���B
�|�C���g. 35���ȏ�̐ݒ�͍זE�Ƀ_���[�W��������̂Œ��ӁB �@[���X�gC]�֖߂�B
��2b. �����ޗ��̎ʐ^�ƍH���ʂ̕K�v���i���i���ʎZ�o�\�ցF3.1 Exp A�A3.2 Exp B�A�ޗ�����ցj
��3�@�זE�����L�b�g�̍\���i�̐��ʎZ�o�@�F�l���P��
�@3.1 �����L�b�g�\���i�F���ʎZ�o�\�ƕ��@�iExp A�FCG-�P���|�{����)�E�E���N�G�X�g�O�̊m�F
- ���\�������L�b�g�\���i�́u����Ɛ��ʎZ�o�@�v�ł��B����A������B�ɋ敪���ĕ\�L���Ă��܂��B���̉���͎���A�Ɍ����������ł����A����B�̕\�L�𗝉����邽�߂ɂ��K�v�ł��B
- ��u�ґ����̏ꍇ�́A���O�ɋ��c�E�b���������s���A�ȃG�l�E��R�X�g���Ɍ��������ݗ����ƑK�v�ł��B�u�v���E�ȕցE�m���E�����I�v�ɉ����u�ȃG�l�E��R�X�g���v�͋��ގ����n�̕K�{�ۑ�ł��B
- ���\�̕��i�ȊO�ɐV�i�̎��R�b�v��e�[�v�Ȃǂ̕K���i���K�v�ł��B��}�ʐ^���m�F�B
- �זE�����L�b�g���w�K�̏�Ŏ��{����ꍇ�́u�S�l�P�O�[�v/�ǁv��O���Ƃ��ď������܂��B���\�̐��ʂ͂��̊ϓ_���痝�����܂��B�������@��ޗ��iSet 3 ���邢�� �}���W:DIY�זE�����j�𗝉�������ŎQ�Ƃ��Ă��������B�s���E�^��͋C�y��E-Mail�H�]���܂ŁB
- ���\�Ƃ��̉�����uPDF����v�Ŋm�F����ꍇ�́u�R�R�v���N���b�N�B
- �����w�K�̎�u�҂������ꍇ�i���\�l�ȏ�̏ꍇ�j�́A�A���d�l�͌ʃp�b�N�łȂ��ꊇ���đ���ꍇ������܂��B����͎�u�҂ւ͔z�z���₷�����@�ɍH�v���Ă��������B
- �uB.�Œᐔ�ʁv�̎Z�o�̗��R�ƌo�܂́u�\���̉���v���Q�ƁB
�H���F(1)CG�̏���→(2)�זE�����i���S�ĕ��V�j→(3)�|�n�E�זE�t�̓H���Ɣ|�{→(4)�Œ���F
��3.1 ��ޗ��̐��ʎZ�o�\�ƕ��@�iExp A�FCG�P���|�{����)�F����͕\���ł���
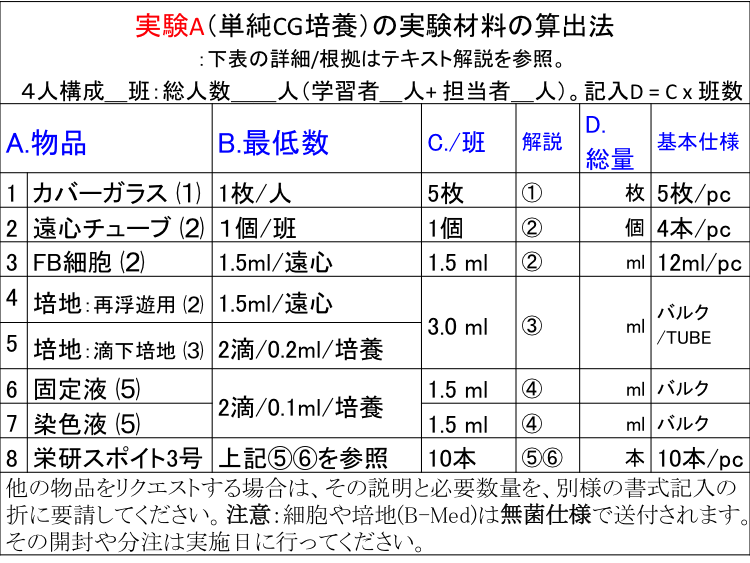
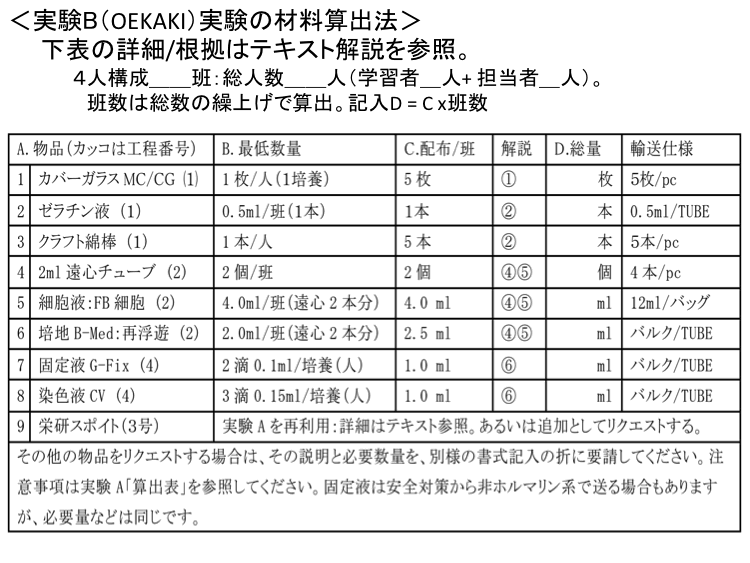
�� �S�l�\���ŁQ�Q�ǁA���l���Q�Q�l�i�w�K�ҁQ�l+ �S���ҁQ�l�j�B
�� �ǐ��͑��l���̌J�グ�ŎZ�o�BD ������ = C x�ǐ��B�@�ޗ��̎ʐ^�́u�R�R�vA. ���i�i�H���j ���� B. �Œ�K�v���� C.����/�� D.������ E.�A���d�l 1 �J�o�[�K���X (1) CG 1���i�Q�|�{/CG�j /�l 5�� �Q�Q�� 5��/pc. 2 ���S�`���[�u (2) CT 2ml�e��tube �P��/�� 1�� �Q�Q�� 4�{/pc. 3 �זE(�t) (2) Cell 1.5ml/���Stube 1.5 ml �Q�Qml 12ml/pc. 4 �|�n/Step 2 (2) B-Med 1.5ml/�ĕ��V 3.0 ml �Q�Qml �o���N/pc. 5 �|�n/Step 3 (3) B-Med 2�H/�|�{x 2�|�{ = 0.2ml 6 �Œ�t (4) Fix 3�H/�|�{x 2�|�{ = 0.3ml
�i0.3ml/2�|�{/CG�j2.0 ml �Q�Qml �o���N/tube 7 ���F�t (4) CV 2.0 ml �Q�Qml �o���N/tube 8 �h���X�|�C�g3�� SP 5�{/�� 5�{ �Q�Q�{ 10�{/pc 9 5�{/���{�S����/�S�� �@�@5 �{ ��L�́u�זE�����L�b�g�v�̊�{�d�l�BC�͗\�����܂߂����ʁBE�͈ꊇ�i�o���N�j�̏ꍇ������܂��B�����ɂ͏�L�ȊO�̕��i�u�Ⴆ�X���C�h�K���X�≓�S�@�A���i�v�L���Ȃǁv��K�v�Ƃ��܂��i���p�ґ��ŏ������܂��j�B���������N�G�X�g����ꍇ�́A���̐����ƕK�v���ʂ���L�����ɏ]���A���E���c���K�v�ł��B�����F�זE��|�n(B-Med)�����ێd�l�ő��t����܂��B���̊J���╪���͎��{���ɍs���Ă��������B �Ȃ��A�X�|�C�g�́u�P�H�͖�0.05ml�v�Ƃ݂Ȃ��܂��B
����\������F���ʎZ�o�̊��
�� ���L���Ӗ��s���ȏꍇ�͎����}�j���A��������ޗ����Q�Ƃ̏�ʼn��߂ė����ɓw�߂Ă��������B
- 1. �J�o�[�K���X(CG)�u�H��(1)�v�F�@CG�͈�l1���Q�|�{�i�Q�̉t�~�߃T�[�N����`���j�Ŏg�p���܂��BCG�P���łQ�|�{���\�Ȃ̂ŁA���E�̃T�[�N���i�|�{�ʁj���u�|�{���Ԃ̍��فF�Ⴆ�A5���|�{��30���|�{�v�ȂǔC�ӂ̖ړI�Ɏg�p���܂��BCG�͂S�l�ǂ�����\���P����^���A�Ǔ�����̕K�v���ʂ͂T���ł��B
- 2. ���S�`���[�u�i2ml�e��tube�j�u�H��(2)�v�F �Ǔ�������K�v���͂P�B�����ɂ͗\���������܂߂܂��B
- 3. �זE�t�u�H��(2)�v�F�@�t�B�����o�b�O�זE�iFB�זE�j�́A�S�l��/�ǂ�����̕K�v�ʂ�1.5ml/���S�`���[�u�ŏ\���ł��B���S�����i6500rpm 10�b�j�̌�A����(1.5ml)�̉t�̔|�n�iB-Med�j�������ĕ��V���܂��B
- 4�E5. �t�̔|�n�iB-Med�j�u�H��(2)��(3)�v�F�@���̗p�r�͉��S��̍ĕ��V�Ɣ|�{�J�n���ɗp����H���|�n�ł��B�P�T�[�N����B-Med�Q�H�i��0.1ml�j��H�����AStep2�Œ��������זE�t�iCR���E�j��1�H�i��0.05ml�j�����|�{���J�n���܂��B�]���āA�ǂ������B-Med�̕K�v�ʂ́A���S������̍ĕ��V�p��1.5ml�B�T�[�N���H���p�͂Q�H0.1ml/1�T�[�N���̂Q�|�{�i�Q�T�[�N���j�Ȃ̂łS�l����0.8ml�Ȃ̂ŁA�|�n�̍Œ�K�v�ʂ�2.3ml�ł����A�\��CG���܂�10�|�{�Ȃ̂ŁA�]���āAB-Med�̔z�z�ʂ͗]�T��^��3ml/���Ƃ��܂��B�z�z���悷�鎞�͂���ȏ�̑��߂��K���Ă��܂��B
- 6�E�V. �Œ�t�E���F�t�u�H��(4)�v�F�@�Œ�t�iFix�j�͂P�T�[�N��������3�H�i��0.15ml�j�A���F�t�iCV�j���R�H�Ŏ��{���܂��B�]���āA���̕K�v�ʂ͂Q�|�{�Ɨ\�����܂�10�|�{�Ȃ̂ŔǓ�����̕K�v�ʂ�1.5ml�ł����A�z�z�ʂ͗]�T���^�����ꂼ��2.0ml�B�Ȃ��A�Œ�t�����S���z���}�����n���g�p���܂��B
- 8�E9 �h���X�|�C�g�R���F���̖��̂͏��i���i���ɕς��������i���ł��莯�ʂ̂��߂��̖��̂��g�p���Ă��܂��j�B�h���R���X�|�C�g�͖ړI�p�r�ɑΉ������A���ʁE�g�������Ŏg�p���܂��B�g���E���p�̓_���i�����g�p���זE�|�{�ƍזE�^���ɋ����e����^���܂��j�B�܂��A�{�X�|�C�g�͒ʏ�́u�t�̏o������v�Ȃǂ̗p�r�̑��ɁA��p�����ǂƂ��Ă��g�p���܂��B�܂�A�X�|�C�g�̃�����2.0���x�����n�T�~�Őؒf���A��������X�|�C�g��������/��p�������i�n�t�̕����E�z�z�p�j�Ƃ��Ă��p���܂��B�S�l�Ǔ�����̕K�v���͂���ŗ\�����܂߂T�{�ł��B�܂�A���̗p�r�́A�P�j�זE�t�̍̎敪���p�A�Q�j�t�̔|�n�̕���E�Y���E�H���p�A�R�j�זE�̍ĕ��V�p�A�ƂS�j�t�̔|�n�悷��u����X�|�C�g�v�p�ł��B���̑��ɌŒ�t�p�A���F�t�p���K�v�ł����A�Œ�t�Ɛ��F�t�ɗp����X�|�C�g�́u�g�p�ς݃X�|�C�g�𐅐�E����v���čė��p���܂��B�ȏオ��u�҂S�l�p�̕K�v���ł��B
�@����ȊO�ɁA���{�ӔC�҂��S���E�p�ӁE�K�v�Ƃ���X�|�C�g���\�����܂�5�{�Ƃ��Ă��܂��B�܂�AStep 2�̃t�B�����o�b�O�זE�̑O�����p��t�̔|�n�iB-Med�j�̕����p�Ȃǂɗp���܂��B - �⑫�P�F�Œ�t�E���F�t�͒�R�X�g���̂��߁A�w�Z����̃K���X���̏������ǂ��g�p���Ă��������B����o�C�A����50ml�r�[�J�[��]�|�h�~�p�I��������ꂽ�����v���J�b�v(��)�ɗ��ė��p���܂��B
- �⑫�Q�F���ʉ��S�@�ł͂Ȃ��ʏ��15ml�o�P�b�g�̉��S�@�̏ꍇ�́A�X�|�C�g�̐���̒����߂��A���̐���X�|�C�g�����S�`���[�u�Ƃ��Ďg�p���邱�Ƃ��\�B�������A���S���x��2000rpm�ȉ��Ŏg�p����B
- �⑫�R�F���S�ĕ��V�����זE�t�iCR�זE�j1.5ml��30�̎���A(CG�P���łQ�|�{�Ȃ̂�15�l��)�ɑ������܂��B�܂��A�t�B�����o�b�O�זE�͒ʏ�12ml��Ȃ̂Ŗ�120�l���i�Q�T�[�N���|�{��120�j�̎���A�iCG�P���|�{�j�ɑ������܂��B
- ����A�̎c��iFB�זE�j�͎��̎���B�iOEKAKI�j�ɗp���܂��B
- ����A��PDF����p
���擪�s�ֈړ��E�ڎ�����
3.2 �����L�b�g�\���i�F���ʎZ�o�\�ƕ��@�iExp B�FCG-OEKAKI����)�E�E���N�G�X�g�O�̊m�F
- ���\�̍l�����͏�L�́u3.1�FCG�P���|�{�����v�Ɠ����ł��B�O�y�[�W�u����A�v�̉���𗝉�������ŁA���L�u����B�v�̗�����i�߂Ă��������B
- �������A��u�ґ����̏ꍇ�́A���O�ɋ��c�b��������ȃG�l�E��R�X�g����͏d�v�ł��B���ݗ����ƑK�v�ł��B�Ⴆ�A���S�������s�킸�����Ԃ̐Òu�|�{�i���u�|�{�j�ł̑Ή����\�ł��B
- ����A/B�ꏏ��PDF����p
�H���F(1)CG�̏���→(2)�זE�����i���S�ĕ��V�j→(3)�|�n�E�זE�t�̓H���Ɣ|�{→(4)�Œ���F
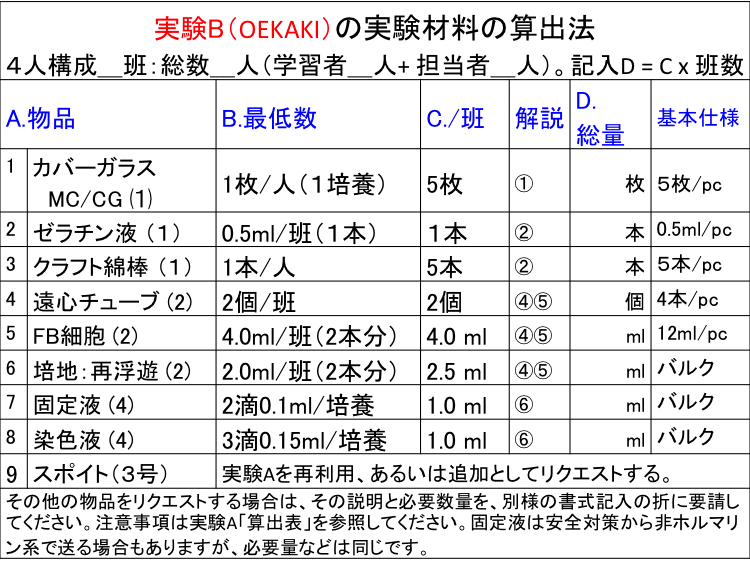
����ޗ��̐��ʎZ�o�\�ƕ��@�iExp B�FCG-OEKAKI����)�F����͕\���ł���
�� �S�l�\���ŁQ�Q�ǁA���l���Q�Q�l�i�w�K�ҁQ�l+ �S���ҁQ�l�j�B
�� �ǐ��͑��l���̌J�グ�ŎZ�o�BD ������ = C x�ǐ��@�ޗ��̎ʐ^�́u�R�R�vA. ���i �i�H���j ���� B. �Œ�K�v���� C.����/�� D.������ E.�A���d�l 1 MC�J�o�[�K���X (1) MC/CG 1�� /�l 5�� �Q_�� 5��/pc 2 �[���`���t (1) Gel �������� 0.5ml �Q_tube 0.5ml/tube 3 �N���t�g�Ȗ_ (1) CS 1�{/�l�i�|���ł��\�j 5�{ �Q_�{ �T�{/pc. 4 ���S�`���[�u (2) CT 2ml�e��tube 2��/�� 2�� �Q_�� 4�{/pc. 5 �זE(�t) �@(2) Cell 2.0ml/���Stube x 2 4.0 ml �Q_ml 12ml/pc. 6 �|�n/Step 2�@(2) B-Med 1.0ml/�ĕ��V x 2tube 2.5 ml �Q_ml �o���N/pc. 7 �Œ�t (4) Fix 3�H/�|�{ �F 0.15ml 1.0 ml �Q_ml �o���N/tube 8 ���F�t (4) CV 1.0 ml �Q_ml �o���N/tube 9 �h���X�|�C�g3��
�i����A�̍ė��p�jSP 5�{/�� 5�{ �Q_�{ 10�{/pc 10 5�{/�S����/�S�� 5 �{ �\����͑O�q�́u����A�v�Ɠ����B��L�́u�זE�����L�b�g�v�̊�{�d�l�ł���A���p�҂Ƃ̋��c�Ɋ�Â����ς��\��B���p�ҏ����̃X���C�h�K���X�Ȃǂ́u�ޗ��ꗗ�v�Ŋm�F���K�v�ł���B�⑫.�@MC�J�o�[�K���X �i���`���Z�����[�X�����ς݂̃J�o�[�K���X�FMC/CG�Ɨ��L�j�B�����F����A/B��O�゠�邢�͓����ɍs�Ȃ��ꍇ�A�u8,9�̃X�|�C�g�v�͎���A�ŗp�����X�|�C�g�����̗p�r�ʂɍĎg�p���Ă��������B�X�|�C�g�́u�P�H�͖�0.05ml�v�Ƃ݂Ȃ��܂��B
����\������F���ʎZ�o�̊��
�@�i�O�y�[�W�u����A�v�̉���𗝉�������ŁA���L�u����B�v�̗�����i�߂Ă��������B�j
- 1. �J�o�[�K���X(MC/CG)�u�H�� (1)�v�F�@����B�ł����`���Z�����[�X�����ς݃J�o�[�K���X�iMC/CG�j��p���܂��B�`���u�t�~�߃����O�v�i�|�{�ʁj�͂P�ł��B�\�����܂��ǂ������MC/CG��5����z�z���܂��B
- 2�E3. �[���`���t(Gel)�ƖȖ_�u�H�� (1)�v�F�@MC/CG�ɓh���i�h��t���j����Gel�̕K�v�ʂ́A�Ȗ_��[�ɏ��ʂȂ̂ŁA�ǂ�����̔z�z�ʂ�0.5ml�ŏ\���ł��B�Ȗ_���ǂT�{�Ŕz�z���܂��B�������A���[���Ȗ_�ł���ꍇ�͂��̔����ł��B�n�T�~�Ŕ����ɐ���g�p���܂��B�Ȃ��A�H�p�u�|���v�ł���p���\�ł��i�ޗ����Q�Ɓj�B
- 4. ���S�`���[�u�i2ml�e��tube�j�u�H�� (2)�v�F �Ǔ�������K�v����2�B�����͗\���������܂߂܂��B
- 5�E6. �זE�t���t�̔|�n�iB-Med�j�u�H�� (2)�v�i�Q�{�Z�k�זE�t�̍����ƕK�v�ʁj�F�@
�@����B�ł��P�T�[�N���ɂU�H�i��0.3ml�j��H�����זE�|�{���s���܂��B�S�l�ǂȂ̂ōŒ�1.2ml�̍זE�t���K�v�ł����A����B�ł͂Q�{�Z�k�̍זE�t��K�v�Ƃ��邽�߁A���L�̕��@�ʼn��S�ĕ��V�����̍זE�Z�k�t�����܂��B
���ǂ�����Q�{�̉��S�`���[�u�ɁA�t�B�����o�b�O�זE�iFB�זE�j�����ꂼ��2ml�������A���S�����i6500rpm 10�b�j�B�㐟�݂������A�^�b�s���O��������������A���ꂼ���1ml��B-Med�������ĕ��V�����Q�{�Z�x�̍זE�t�Ƃ��܂��B
�i���Z�x�̍זE�t�̒������K�v�Ȃ��߁u�Qml�̍זE�t�v�ɑ��u1ml��B-Med�ōĕ��V�v���זE�Z�k�t�����܂��j�B
�@�Q�{�̉��S�`���[�u��p�����̂ō��v2ml�̔Z�k�זE�t����������܂��B�Ȃ��A����B�œH������זE�t�̗ʂ�6�H�i0.3ml�j/�T�[�N���ł��B�]����2ml�̔Z�k�זE�t��6�l���A6��̂��G�`�������ɑ������܂��B
�@�]���āA�ǂ�����̔z�z���ʂ́A�זE�t�iFB�זE�j���Sml�A�ĕ��V�p��B-Med�͗]�T��^��2.5ml�ł��B
���⑫�FCG-OEKAKI�����𐔏\�l�ȏ�ōs���ꍇ�͎�X�̕ϖ@���Ă���ꍇ������܂��B - 7�E8. �Œ�t�iFix�j�E���F�t�iCV�j�u�H�� (4)�v�F�@�Œ�t�E���F�t�Ƃ��ɕK�v�ʂ�3�H�i��0.15ml�j�ł��B�S�l�ǂ�������z�z�ʂ́A�]�T�∵���₷�����l�����AFix�ECV�Ƃ�1ml�ŏ\���Ȃ͂��ł��B�Œ�t�́A�w�Z�ŗ��p����ꍇ�A���S���z���}�����n�ő���ꍇ������܂����A�K�v�ʂȂǂ͓����ł��B�Ȃ��A�����̗n�t�͊w�Z����̏������ǂȂǂɕ������z�z���A�g�p�ς݂̃X�|�C�g�𐅐��čė��p�ŗp���܂��B
- 9. �h���R���X�|�C�g(����E�n�t�����p)�F ����B�͎���A���s�����゠�邢�͒���Ɏ��{�Ƃ��邽�߁A�ł��邽�߁A����E�����p�̃X�|�C�g�͎���A�Ŏg�p�������̂��ė��p���Ă��������B����A�ƕʂ̓��Ɏ��{�̏ꍇ�́A�g�p�ς݃X�|�C�g�����X�|�C�g�i�����ǁj���A�������œ��e�����\���ɐ����A�������őA����A�ė��p���Ă��������B
- ����A/B�ꏏ�̎����ȈՃ}�j���A���iPDF����p�j
���擪�s�ֈړ��E�ڎ�����
4. �זE�����L�b�g�̃��N�G�X�g�Ǝ��{�l���F�m�F����������@
��4.1 �זE�Ǘ��ƗL�������ɂ��ā�
��4.2 �ŏ��̈���́u���N�G�X�g�O�̏m�F�v�F�l���P��
��4.3 ���{�v��̗��āE���c�̂��߂ɁF�l���Q��
�@�@�k4.3-A. ���{�v��\�l�@�k4.3-B. ���̑��̏l�@�k4.3-C. ���̑��̕��i�̃��N�G�X�g�l
�@�@�k4.3-D. ���R�L�q�F����⊴�z�E��āl
��4.4 ���{�I����̏��̂��߂ɁF�l���R��
�@�@�k4.4-A. ���{�L�^�\�l�@�k4.4-B. ���|�[�g�̗l���F�����I����Ɂl�@
��5. �����L�b�g�̕t�я����i���L�j��
�͂��߂ɁF�@�F���u�����Ă݂����E���{���悤�v�Ɨ\��E�v�悷��זE�����́AWeb�T�C�g�ŏЉ���ʂ�A�����Ă��鋛�ޔ|�{�זE��p���܂��B���w�҂ɂ̓C���[�W���ɂ������Ƃł����A�������������Ă��铮���|�{�זE��Ready-To-Use�̏�ԂŗA�����A���Z�p��K�v�Ƃ����זE�����ɗp���邱�Ƃ͂قڕs�\�ł����A�{�V�X�e���͂��ꂪ�\�ł��B����ŊȒP���L�E���ގ����n�Ƃ��Č��ؒ��ł��B
�@�������A��͂�A����ł��A����̏d�v�ȃ|�C���g������܂��B���̂ЂƂ����L�́u4.1.�זE�Ǘ��ƗL�������v�ł��B����͂ƂĂ��d�v�Ȃ̂ŁA�זE�i�t�B�����o�b�O�זE�j����������O�ɂ��̈Ӗ��̂����������肢���܂��B�܂��A�זE������\�蒲�a�I�ɐi�߂�ɂ͓�����v�����ł��B���̂��߂ɉ��L�u�ڎ��v�̂悤�ȍ��ڂɂ��Ċm�F���Ȃ������悭�������i�ނ悤�Ɍv�悵�Ăق����Ǝv���Ă��܂��B����ŁuDIY�זE�����v�ł��B
�@���L���Q�ƌ�A�����A�����Ă݂����ꍇ�͓d�q���[���ŋC�y�ɂ��A�����������B�Ƃ肠�����b�����������܂��傤�B�����ɁA���̕����Ɨގ��̏�����d�q���[���ő��t���܂��B���̖ړI�͊w�K���ނƂ��Ă̖{�����n���u�ŏ��w�́E�ő���ʁv�ƂȂ邽�߂ł��B�ȒP���L�ɂ����؎��������҂��Ă��܂��B�����͂����肢�\���グ�܂��B�@
��4.1. �זE�Ǘ��ƗL�������ɂ�����
-
��z�A�������ꍇ�A�t�B�����o�b�O���̍זE�́A�A�����̐U���̂��߁A�o�b�O�̊p�Ȃǂ̈ꕔ�Ɋ��W�܂�A���I�ȑ傫�ȋÏW��ɂȂ�܂��B���̏�Ԃ͍זE�ɂƂ��čň��ȉߖ��ÏW��ԂȂ̂ŁA����͑��₩�ɐ����U����^���A�זE�U�����A���L�ɏ]���Ă��������B����ŁA�����\����͎��ҋ@���s���ł��B
-
�t�B�����o�b�O�זE�̗L�������́A����A�����Ǘ����Łu�T�����v�ł��B�����i0���ځj�̃t�B�����o�b�O�זE�͋x�{���K�v�Ȃ̂Ŏ����ɂ͎g�p�ł��܂���B�זE�o�b�O�́u���u���E�Òu�E�����v�ŕۑ��E�Ǘ����܂����A�\�Ȃ���Ɉ�x�A�����U����^���A�זE�ÏW�U����ɂ��Ă��������B �����Ƃ́u�l�ɂƂ��ĉ��K�ȉ��x��F20���ȏ�v�ƍl���Ă��������B������͏������ӂ��Ă��������B�A���A�{�זE�͒ቷ�ɂ͑ς��܂����A�����O�ɂ͊ۈ���Ԃ̎����ۑ����K�v�ł��B
-
�זE�o�b�O���J������Ƃ��̗����ɂ̓R���^�~�l�[�V�����i�G�ۑ��B�j��������댯��������̂ŁA�זE�o�b�O�̊J���͎������{���ɍs���܂��i��������Ɏg�p���Ă��������j�B
-
�זE�͓��X�ɂ₩�ɑ��B���Ă��܂��B���̌��ʁA�L�������̌㔼�i4,5���ځj�ɂ͂��̔Z�x��1.5�{���x�ɂȂ�\��ł��B���̌�͔|�n�����̗ɂ��זE�������ቺ���܂��B���̂��ߗL��������ݒ肵�Ă��܂��B
-
�Ȃ��A�[�����ۑ���ɂ�蒚�J�ȑ�����s���A����ɕ����ē���t�B�����o�b�O�̍זE�t���g�p���邱�Ƃ��ł��܂��B�܂��A�L�������̉������\�Ȏd�l�ł̒��\�ł����A���̏ꍇ�́A�����O���[�v�̌o���҂Ȃǂ̃A�h�o�C�X��K�v�Ƃ��܂��B���w�҂̏ꍇ�͊�������Ŏg�p���Ă��������B
���擪�s�ֈړ��E�ڎ����A�S�̖ڎ�����
��4.2 �ŏ��̈���́u���N�G�X�g�O�̏m�F�v�F�l���P��
- �@�זE�����L�b�g���u�����Ă݂����E�����w�K�ɗp���Ă݂����v�Ȃǂ̌o�܂���A�������ꍇ�A�ŏ��ɂ��̕����u4.2�v��d�q���[���ő��t���܂��B���L�́u�l���P.���N�G�X�g�O�̏m�F�v�ł��B�K�v�������L�����A������ĂȂǂ��܂߁A�d�q���[���ŕԑ����Ă��������B�A���A�}�N���@�\�Ȃǂւ̕ϊ��Ȃǂ͍s��Ȃ��ł��������B
- �@���w�҂ɂ͈Ӗ��s�������X����Ǝv���܂��B���̏�ł����u�����Ȃ��E�C�y�ɁE�i�K�I�E�����I�Ɂv�͏d�v�ł��B����ŁA���L�̋L�q�L���̓r���ł����Ă��C�ɂȂ邱�Ƃ͋C�y�ɂ����₭�������B�������ɂȂ邱�ƂȂ����ݗ����Ɋ�Â��������i�߂܂��傤�B
- �@�Ȃ��A�����L�b�g�̒͋��ފw�K�Ɍ��������؎����̊ϓ_��������̂Łu�֘A����t�ю����v�����邱�Ƃ����������������B �����͂����肢���܂��B
- �@�H�ɂ��邱�ƂȂ̂ł����u�ǂ܂Ȃ��E�l���Ȃ��E�������Ȃ��v�Ƃ����������Ȃ��悤�ɂ��肢���܂��B
�����L�́u�l���P�F�m�F�v�̎����m�F�����ł���
- �{�����i���t�́@ ���@�@���j���o������t�i�ԐM���j�F�@�@�@�@�@
- ���{�S���ҁi�����҂Ɠ����F�ӔC�ҁj�̎����i�ӂ肪�ȁj�F
- �S���ҁi2�Ɠ����F���ۂɍזE���������j�̏����E�E��E�A����Z���E�d�b�ԍ��F
- �זE�����L�b�g�u�����O�[�v�v�̏Љ�ҁA���邢�́A���͎҂͂��܂����i����ꍇ�͎����Ə����j�F
- �{���̍זE�����L�b�g�����ۂɌ����E���������Ƃ͂���܂����B���邢�́A�m�����o�܂ȂǁA���̏����m�点���������F
- �͂��߂Ċ�]����E�����������������ȋ���̊ϓ_���炻�̌o�܂�ړI����̓I�ɐ��s���x�ł��m�点���������F
- �����}�j���A���kWeb�}�j���A���FSet�R�A���邢�́A�}�����CG�זE�����l���Q�Ƃ��A���Z����̏�Ō˘f����������H���⑀��͂���܂������B����ꍇ�͋�̓I�ɂ��m�点���������F
- �זE�������s�����A���ۂɎQ�Ƃ����Z����ɗp����u�����}�j���A���FPDF�v�͂ǂ̃T�C�g�̂ǂ̕��ʂɂ�����̂��g�p����\��ł����B�����˘f���̎���Ȃ̂ł������肢���܂��F
- �����}�j���A���Ȃǂ��Q�ƌ�����ς�C�������������͂���܂������F
- Web�������Q�ƌ�A�C�ӂ̎���������悭�v���ȕւɎ��{�ł����Ǝv���܂������E����Ǝv���܂����H�F
- ���{�����F�uWeb�}�j���A���FSet�T�F�ޗ��T�v�ƕK�v���ʁA���i�Z�o�@�i�\3-1, 3-2�j�v�Ɋ�Â���������L�b�g�̕��i�i�\���i�Ɛ��ʁj�����܂�̂ŁA�ʓǁE�m�F���A�Ӗ��s���Ăȉӏ�������ꍇ�͂��m�点���������F
- �Ȃ��A�����L�b�g�̒i�A���j�͑��ݗ������m���10����i�ȍ~�j�ɂȂ�܂������v�ł����B��]�Ȃǂ���Ή����Ȃ����A�����������B
�ȏ�F���N�G�X�g�O�̏�Ή��ɂ��Ă��m�点���������B�Ӗ��s���Ȏ����͂��̂܂ܗ����Ȃ��ӌ������肢���܂��B
��4.3 ���{�v��̗��āE���c�̂��߂��F��o�l���Q��
�{���i���L�j�͓d�q���[���{���Ƃ��đ��邱�Ƃ�����܂��B���̏ꍇ�͂��̂܂܋L����A�ԐM��OK�ł��B
�@���\�̋L�����ځuA-H�v�́A�\�̉��́u����v���Q�Ƃ̏�ŁA�L���E���ĉ������B�I�������Y�����Ȃ��ꍇ�͓K�ȗ����ȉ����肢���܂��B
�@���镨�i�i�����L�b�g�j�͉��\�uE.�ǐ��v�Ɋ�Â��������܂����A���̐��ʂ́u�\3-1,3-2�v����Z�o�����̂ŋL���O�Ɋm�F���Ă��������B�Ȃ��A�{�\��o��ɋ��c���K�v�ȏꍇ������܂��B�܂��A���̒i�K�Ō˘f���⋦�c���K�v�ȏꍇ�͋�̓I�ɂ��̊T�v�����m�点���������B���c���܂��傤�B
| �k4.3-A.�@���{�v��\�l �@�i�قڊm��̎������L���B�Z�������L����╡���s�ŋL�����Ă����܂��܂���j |
||||||
| # | A.���{��/�j�� |
B.���{���� |
C.������ |
D.�l�� |
E.�ǐ� |
F.�o�b�O�� |
| �P | ||||||
| G.�ړI�F | ||||||
| H.���̑��F | ||||||
| 2 | ||||||
| G. | ||||||
| H. | ||||||
| 3 | ||||||
| G. | ||||||
| H. | ||||||
#. ���{�ԍ��i���ԁj
�F ���{����(B)��l��(D)���l�����u�����̂Ȃ������v��v�����{�P�ʂȂ̂ŁA
�@ ��������v��̏ꍇ�͂��ꂼ��ɂ��ċL�����܂��B
�@ 4��ȏ��\��̏ꍇ�͒lj��L�����Ă������B�@
A. ���{��/�j���F���{�\����F�זE�o�b�O�������̂��ߊJ��������B�@
B. ���{���ԁF�H��2�ȍ~�̊J�n�I�����ԁA�w�Z���Ԋ��\�̋敪�ȂǁB
C. ���{���������
�@ �F�I��A.CG�P���|�{����,�@B.CG���G�`������,���邢�́AC.�������B
D. �l���F�Q���Ґ��B�E�E�E�S�l�\���ŁQ�Q�ǁA���l���Q�Q�l�i�w�K�ҁQ�l+ �S���ҁQ�l�j�@�@
E. �ǐ��F���̔ǐ��Ɋ�Â��A�\3-1, 3-2������i���Z�o����܂��B�@
F. �o�b�O���F12ml�זE�o�b�O�̐������B�@
G. �ړI�i�I���j�F�\�s���K�A���Ǝ����A�������C��A���k����̕����A�Ȃǂ��L���B
H. ���̑��F���{�T�v��v��Ɋւ��⑫�̂��߂ɗ��p���Ă��������B
�܂��A����B�̍H��4�i�Œ���F�j��B�i���{���ԁj�Ƃ͕ʎ��Ԃɍs���ꍇ�͂��̊T�v���L�����Ă��������B
���擪�s�ֈړ��E�ڎ����A�S�̖ڎ�����
�k4.3-B. ���̑��̏l
- �g�p���鉓�S�����@�Ǝd�l�F
�i��]���@�@�@rpm�@�A�o�P�b�g�E�`���[�u�̑傫���F�@�@ml�j - ���{��������|�{���x�͉��x���炢��z�肵�܂����F
- ������̏ꍇ�͔|�{���x�̐ݒ�@�����m�点���������B
- �E�F�u�e�L�X�g�iQR�R�[�h�̃T�C�g�j��ʓǂ��A�[�����邱�ƁA�Ӗ��s���Ȃ��Ƃ�����A���̏��ݔԍ������m�点���������B
�F�[�����@�@, �Q ,�@�@�@�B�@
�F�Ӗ��s�����@�@, �Q,�@�@�@�B
�k4.3-C. ���̑��̕��i�̃��N�G�X�g�l
3�̃��N�G�X�g�Z�o�\�i�i�j�ɒ������i�ȊO�Œ��K�v�ȕ��i�i�ޗ��ꗗ���Q�Ɓj������ꍇ�͉��\�ɋL�����Ă��������B���邢�́A�i�����ɂ���ꍇ�́u�s�K�v�v�̍ޗ������L�����Ă��������B���Ɂu�h���R���X�|�C�g�v�͖{�҉���̂悤�Ɏ����w�K�̏�ɂƂĂ��L���Ȋ��ł��B�w�Z����̔��i�ƍl���Ă��ǂ��Ǝv���Ă��܂��B�Ȃ��A���S�@�̏ꍇ�́u�݂��o���v�ł��B
| �\4.3-C.�@�lj��܂��s�K�v��������ޗ� | |
| # | �Z�o�\�̕��i�̑��ɕK�v����ޗ��Ɛ��ʁA�ȗ��Ȃ��̐������L������B |
| �P | �lj��F |
| �s�v�F | |
| �Q | �lj��F |
| �s�v�F | |
�k4.3-D. �@���R�L�q�F����⊴�z�l
�@��L�ȊO�Ŏ���⊴�z�Ȃǂ���Ύ��R�ɋL�q�E��Ă��Ă��������F
��4.4 �זE�����L�b�g�̋L�^�����F��o�l���R��
�זE�����L�b�g����������_���牺�\�̗l���ɏ����āA�t�B�����o�b�O�זE�̗l�q�∵�����ȗ��ɋC�y�ɋL�^���Ă��������B�זE�����Ɋւ��ċC�ɂȂ邱�ƁA���Ɍ˘f�������Ƃ⍢�������ƁA�Ȃǂ����؎����̊ϓ_�����ł��B�B���̓s�x�����◪�L���Ă��������B�Ȃ��A�I����͂������肢���܂��B���ׂȂ��ӌ��ł����̕��̗͋����x���ƂȂ�͂��ł��B���肢���܂��B
| �k4.4-A. ���{�L�^�\�F�����l ���{�ړI�F |
||||||
| ���t | A.���x | B.ID | C.�C�x���g | D.�E�R�����g | E.�R���^�~ | |
| 0���� | ���Ƃ��̒ʒm | |||||
| 1���� | ||||||
| 2���� | ||||||
| 3���� | ||||||
| 4���� | ||||||
| 5���� | ||||||
| 6���� | ||||||
| �@���� | �זE�̔j�������� | |||||
| �@���� | ���|�[�g��o | |||||
|
||||||
| ���肢�F���i���t�̐܂͓��������舵���ԍ������O�ʒm���܂����A�w�Z���œ�����ɍs���s�����N����Ȃ��悤�ɔz�����ĉ������i���̒ʒm�����肢���܂��j�B | ||||||
�k4.4-B. ���|�[�g�̗l���F�����I����ɒS���Ҏ��g�̌o������L�q�l
�@���̂S���ڂɂ��āA�d�q���[���ł��m�点���������B��\�Ƃ̊֘A�Ȃǂ���L�q���Ă���������Ώ�����܂��B�Ȃ��A�����ɂƂ��čł��L�p�Ȃ��ӌ�����́u�˘f�������ƁE���������Ɓv�ł��B���Ȃǂł����܂��܂���B
�Ȃ��A�C�Â������ɂ��̓s�x���[�����M�Œ��Ă����������Ƃ��ƂĂ��E�F���J���ł��B�ǂ�����낵�����@�肢���܂��B
- ���{��̊��z�ƈӌ��B�@
- �\�z�O�̎������������E�C�Â����ꍇ�́A�����敪�ƍH���ɉ����i�ӏ������j�A���̏Ɗ��z�E�ӌ��B���Ȃ����B
- �W�{�ώ@�Ɓu�����w���K��Set 2. �ώ@�̎w�j�v�ɂ��āA���H�̊ϓ_����ӌ��Ɗ��z�B
- �W�{�̌��ʁu�������ʐ^�F�����x�̉摜�T�C�Y�v�̒B
- �i��u�҃��|�[�g�̓Y�t���j
5. �זE�����L�b�g�̕t�ю���
1. ���S�m�F�ɂ����{�A
2. ���{�i���{�L�^�E�ӌ��E���ʎʐ^�j�̒A
3. �זE�̍ĕ��^�֎~�A
�@�@���t�я����ł��B
4. �ƂĂ��d�v�Ȃ��ƂƂ��ĕt�L���������Ƃ́u�����Ȃ��E�C�y�ɁE�i�K�I�E�����I�Ɂv�ł��B
�u�A�����c�͑��݂ɐ����Ɂv�ł��肢���Ă��܂��B�ʎ��̂Ȃ����Ƃ̘b�������ɂ͕s���ł��B�@�i�K�v�ɉ����āu���C���v�ɂ�閳���d�b���E�F���J���ł��j�B
5. �⑫. �זE�����L�b�g�͎��H�w�K���ނ�ړI�ɒ���܂��B���̑��̗��p�͋֎~�ł��B���⑫��
�����w�K�E�����Ȋw�̗��O�� �u���̂ƊT�O�̘A���A�g �E �����ĐX�������̉���v �ɂ���B���́u�_���؋��E����ǃ��W�b�N���v�ɂ́u��ݐ��\�����x���v�̋���E�\�����EShowing ��K�v�Ƃ���B�������u�튯�n�E�g�D�v�ɉ����u�זE�@�\�̌n���⋐�啪�q�v�̈����͈�ؓ�ɂ͐i�܂Ȃ��B����ȑO�ɂ����̋N�_�ƂȂ�זE���x���Ƀ��A���e�B�[�����߂��Ă���B�N�����F�߂���m�̎����B�ȒP���L���\�ȍזE�����n�ւ̊��҂ł���B����ōזE�����w�K�͕K�v�s���ł���B���������E�X�b�L���ϊ��̓��̋N�_�ł���A�l����w�K�ւ̌��_�����ƍl����B�i�u�}���W�FCG�זE�����v���V�[�g�R���� �����j
�ȏ�Łu�Z�b�g�T�͏I���v�ł��B
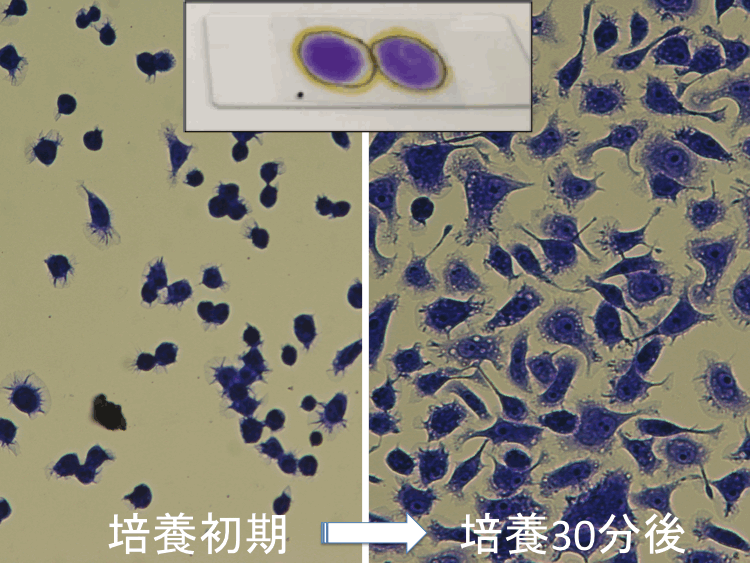
��28-30��
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.28 �@�@�� Fig.29 �@�@�E Fig.30 )
���擪�s�ֈړ��E�ڎ�����
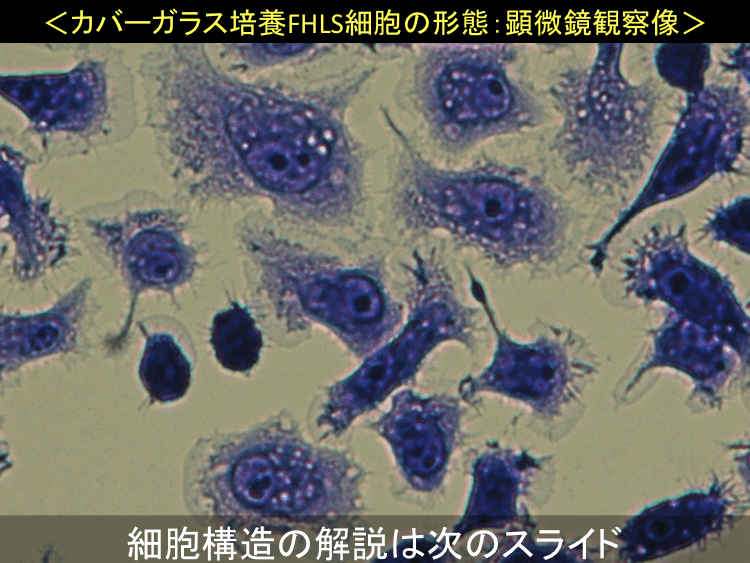
��31-33��
��
�@  �@
�@ �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.31 �@�@�� Fig.32 �@�@�E Fig.33 )
���擪�s�ֈړ��E�ڎ�����
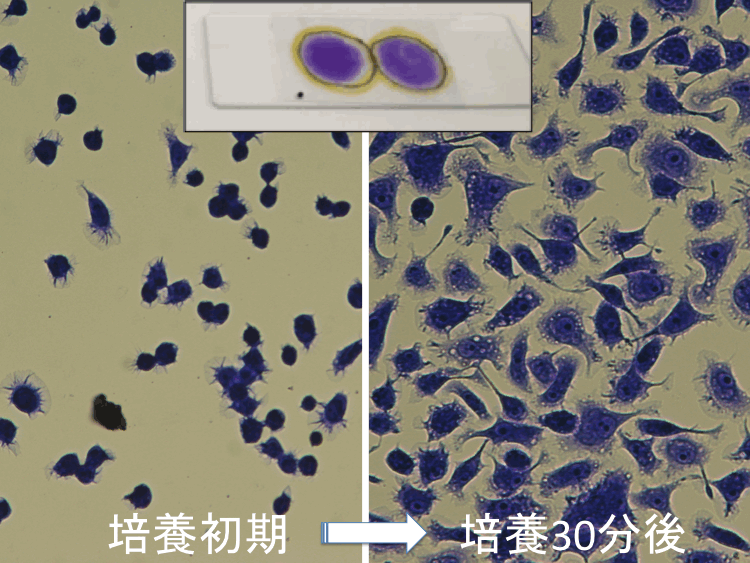
��34-36��
��
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.34 �@�@�� Fig.35 �@�@�E Fig.36 )
���擪�s�ֈړ��E�ڎ�����
��37-39��
��
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.37 �@�@�� Fig.38 �@�@�E Fig.39 )
���擪�s�ֈړ��E�ڎ�����
��40-42��
��
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.40 �@�@�� Fig.41 �@�@�E Fig.42 )�@
���擪�s�ֈړ��E�ڎ�����
��43-45��
��
 �@
�@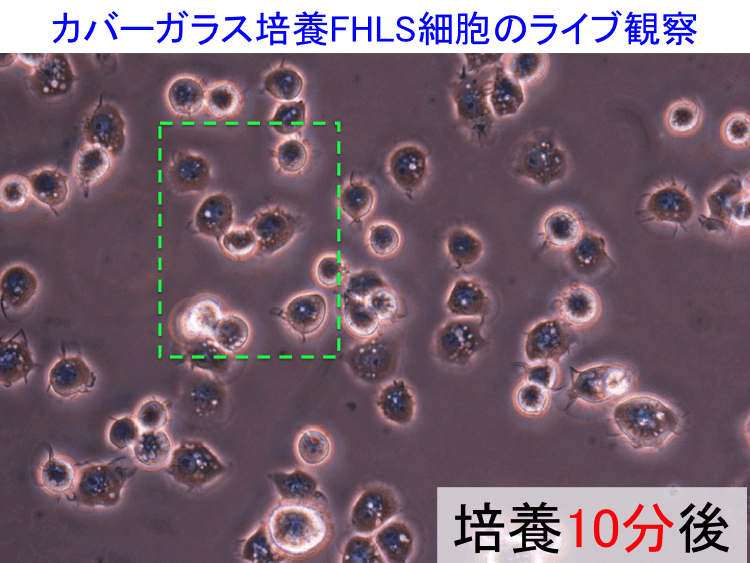 �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.43 �@�@�� Fig.44 �@�@�E Fig.45 )�@
���擪�s�ֈړ��E�ڎ�����
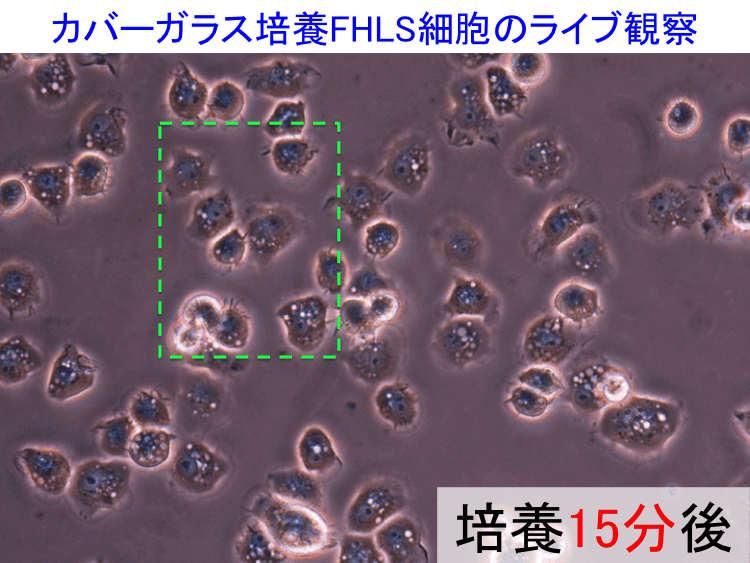
��46-48��
��
 �@
�@ �@
�@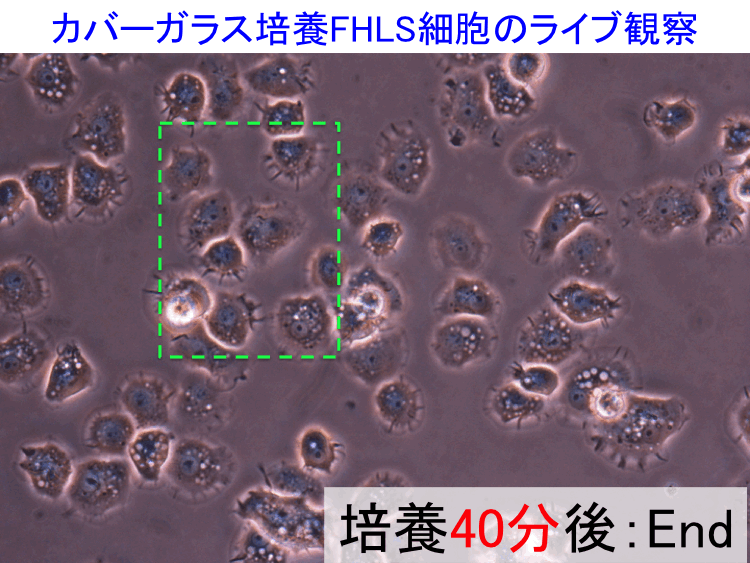
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.46 �@�@�� Fig.47 �@�@�E Fig.48)�@
���擪�s�ֈړ��E�ڎ�����
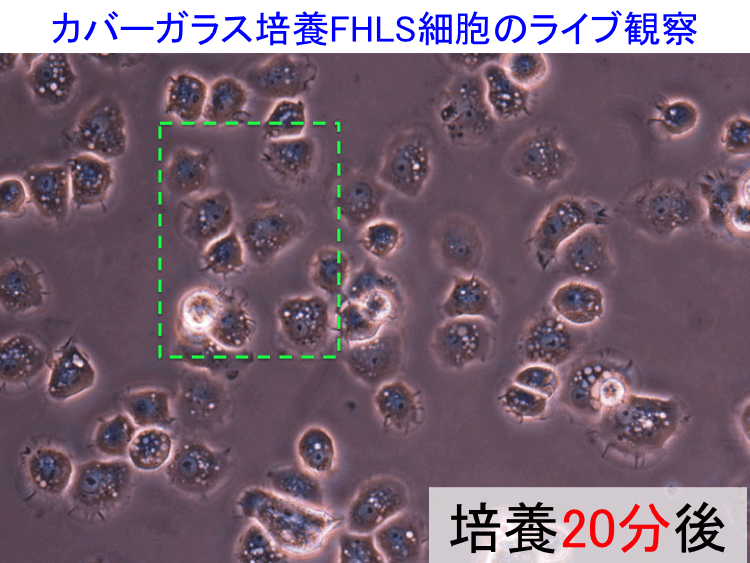
��49-51��
��
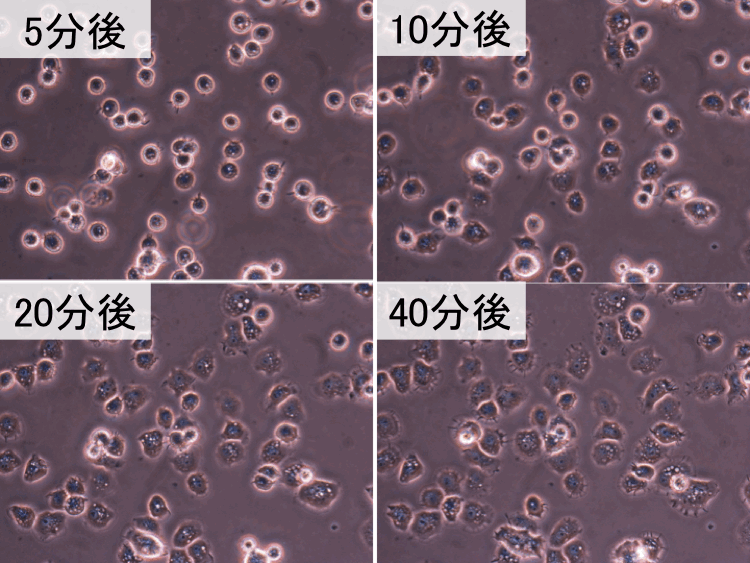 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.49 �@�@�� Fig.50 �@�@�E Fig.51)�@
���擪�s�ֈړ��E�ڎ�����
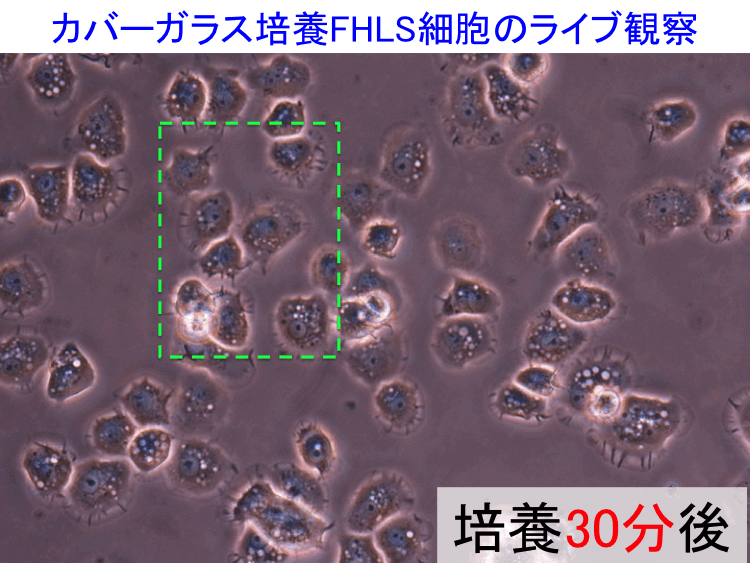
��52-54��
��
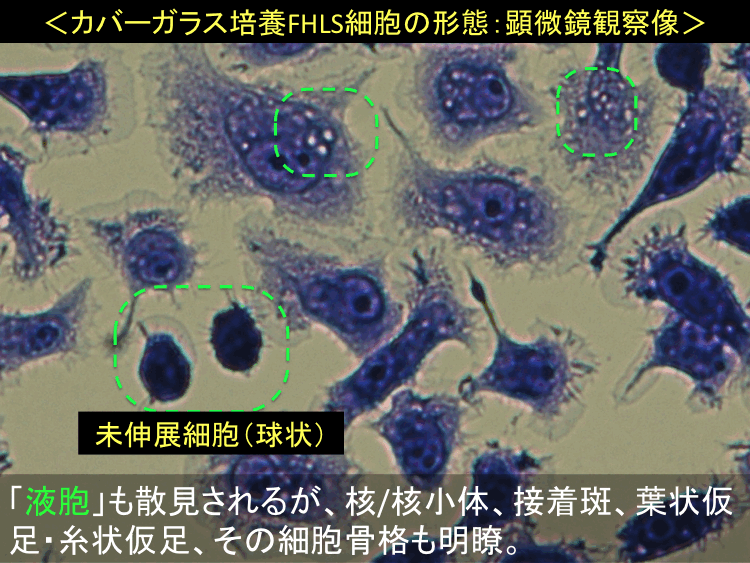 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.52 �@�@�� Fig.53 �@�@�E Fig.54)�@
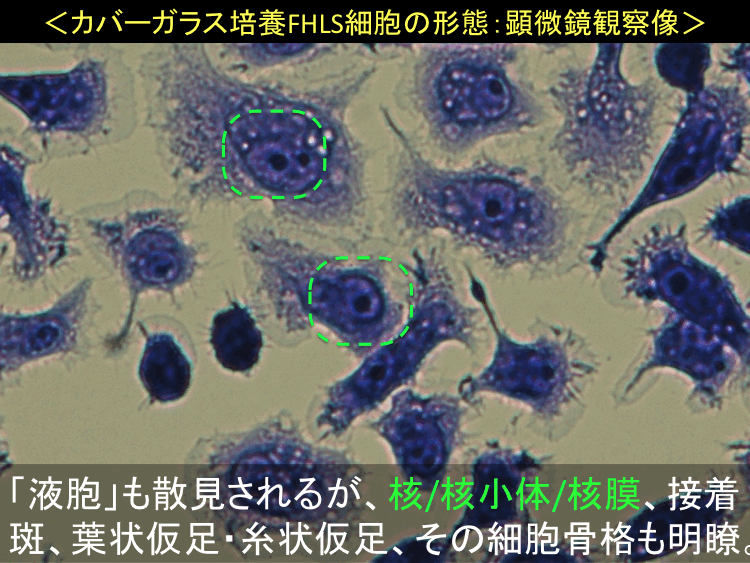
���擪�s�ֈړ��E�ڎ�����
��55-57��
��
 �@
�@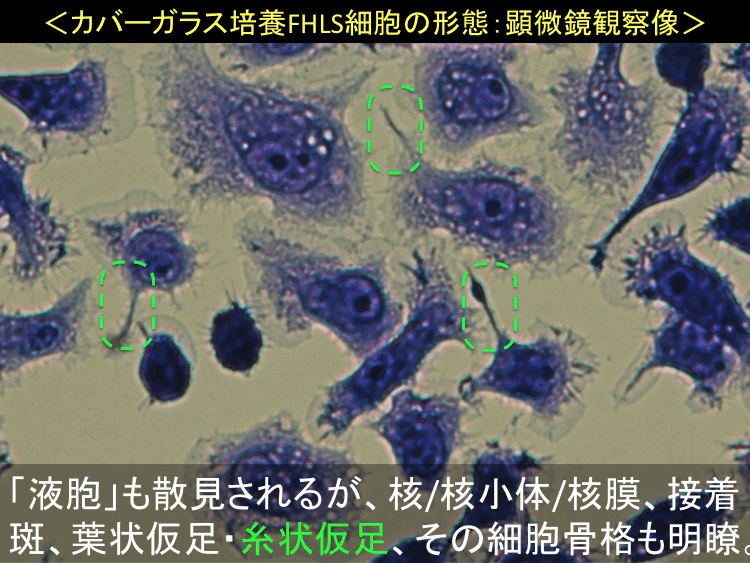 �@
�@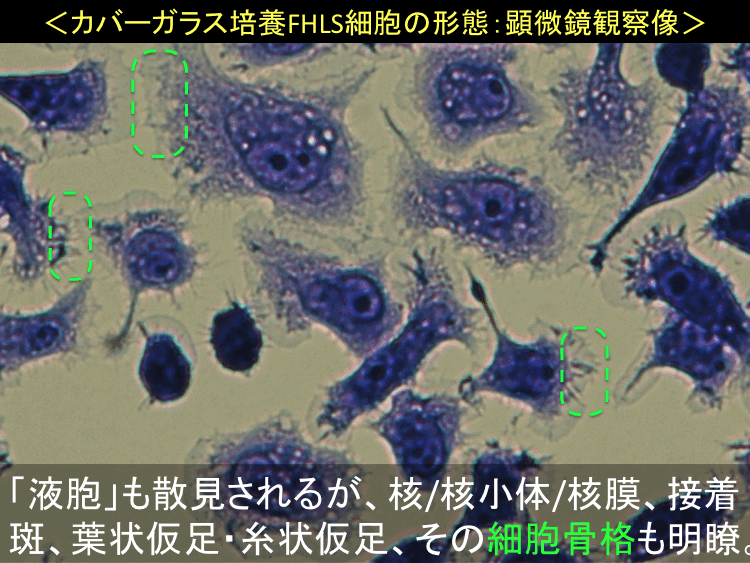
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.55 �@�@�� Fig.56 �@�@�E Fig.57)�@
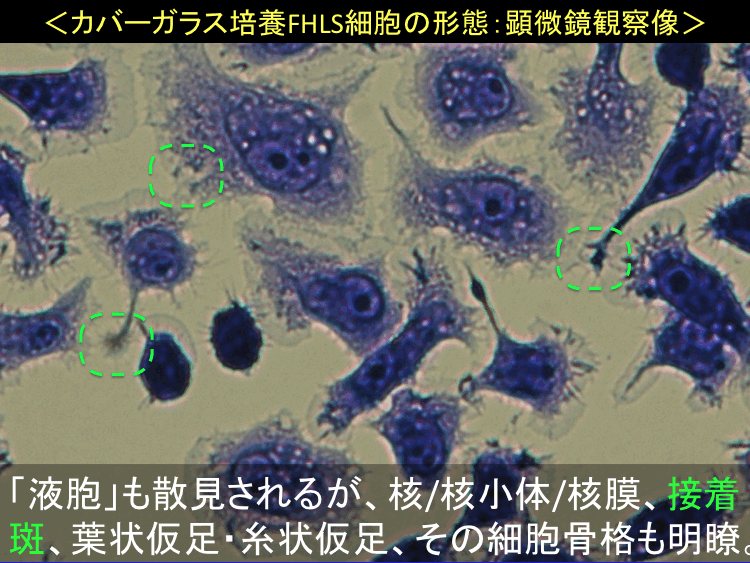
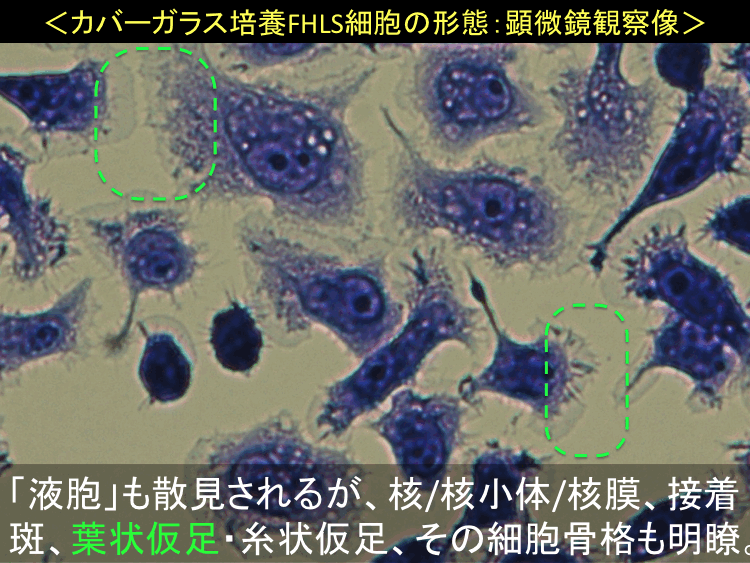
���擪�s�ֈړ��E�ڎ�����
��58-60��
��
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.58 �@�@�� Fig.59 �@�@�E Fig.60)�@
���擪�s�ֈړ���
����������
��