[体の基本10項目] へ戻る 、[見る視点:マクロ組織の話し合い]へ戻る、細胞実験項目のリストへ移動する
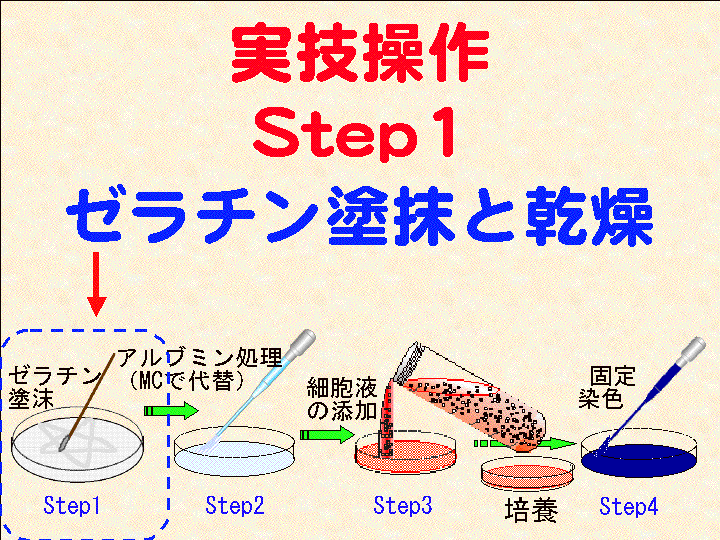
Exp1. お絵描き実験:実技操作マニュアル
(実験操作の時はこのテキストを印刷し、実技操作マニュアルとして用いる)
* カード型の実験手引きへ → ![]() *実験研修の実施要領はココ*
*実験研修の実施要領はココ*
・・・・・・・・・・・・・・ 目次(実験工程)・・・・・・・・・・・・・・・・
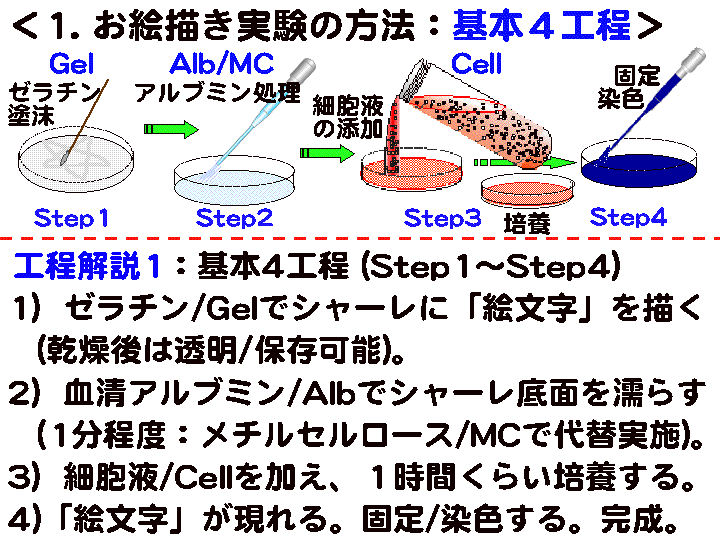
1) Step
0. 実験準備 →
2) Step1. ゼラチン塗抹→ 3) Step2. メチルセルロース処理
→
4) Step3-1. 細胞液の添加
→ 5) 培養1 → 6) Step3-2. 経過確認1 → 7) 培養1+
→
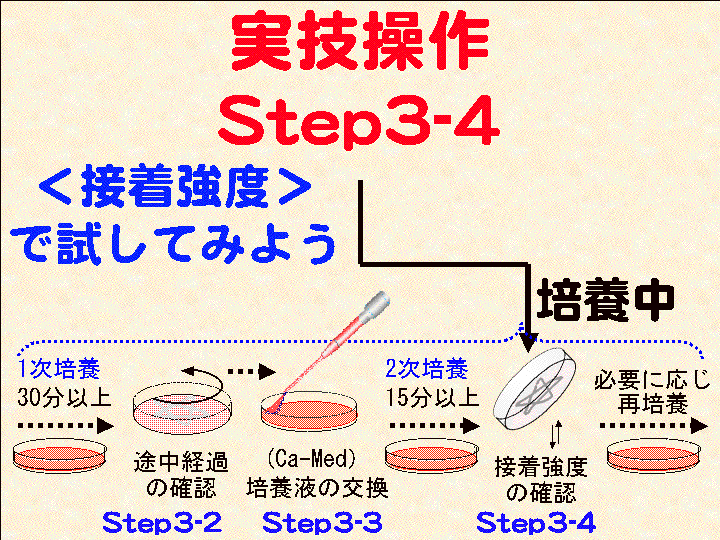
8) Step3-3. 培養液の交換 → 9) 培養2→ 10) Step3-4. 経過確認2
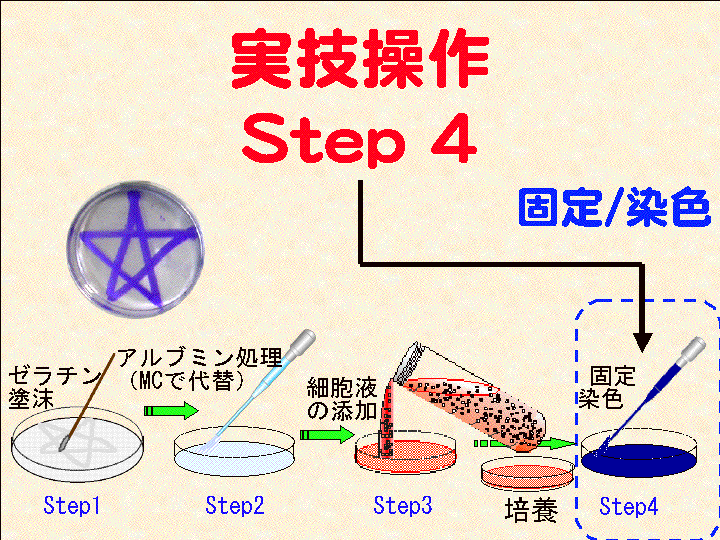
→ 11) 培養2+ → 12) Step4. 固定染色 → 13) Step5. 観察
* 培養時間の設定法:工程の考え方 *
(画像クリックで拡大表示: 左 Fig.0 中 Fig.00 右 Fig.000)
<先頭行へ移動>
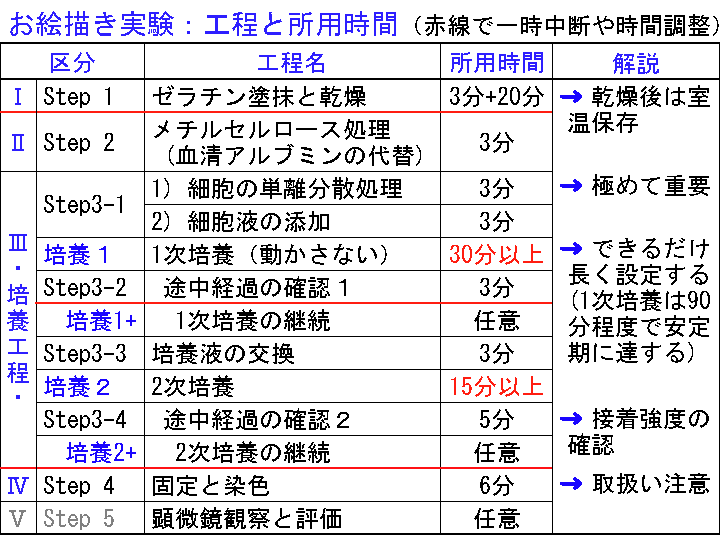
□1)Step0:実験準備:材料と方法の確認 (Fig1-6)
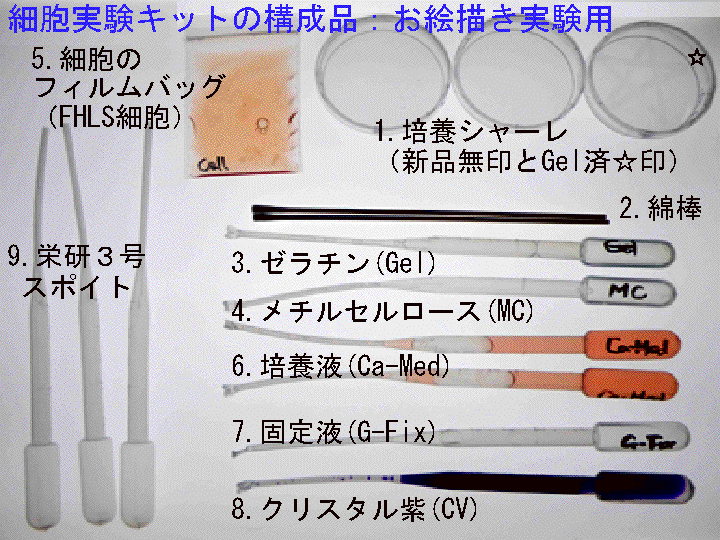
概要:(1) 実験キットの物品に不具合や異物異常がないか確認する。(2) 細胞の有効期限とその状態を確認する:フィルムバッグ内の細胞は塊状でツブツブに見えるので、液を動かし確認する。但し、フィルムバッグは使用直前まで開封しない。(3) 小型ビーカーなどの必要な備品や、培養温度を設定する方法とその実際を確認する。(4) 培養工程(1次培養と2次培養)の時間配分を設定する。「培養時間の設定法/考え方」は文末を参照:ココをクリック)
補足2:(1)本実験では「培養温度」の設定も重要である。基本的には、快適な室温、つまり22℃から28℃くらいで行なう。30℃を超えるとゼラチン溶解が生じることもあるので注意する。


(画像クリックで拡大表示: 左 Fig.1 中 Fig.2 右 Fig.3)
<先頭行へ移動>

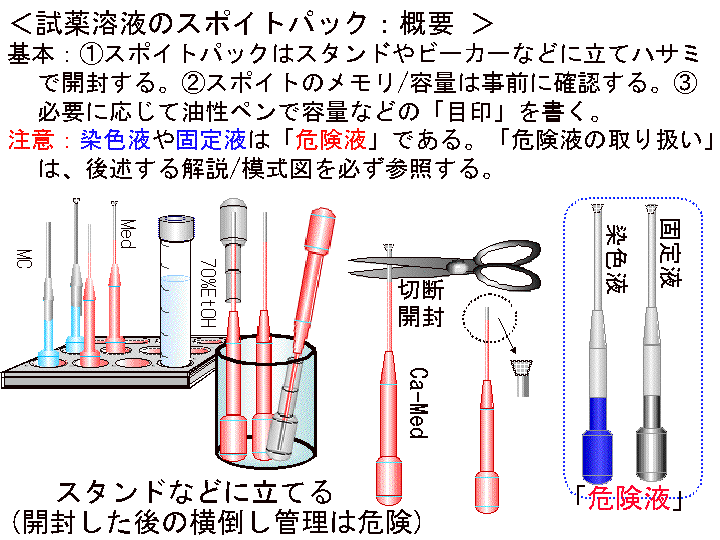

(画像クリックで拡大表示: 左 Fig.4 中 Fig.5 右 Fig.6 )
<先頭行へ移動>
□2)Step1:ゼラチン (Gel) 塗抹と乾燥 (Fig7-9)
概要:□1) スポイトパック(Gel)を中程で切断開封し、熱湯を入れた小カップ中に浸し加温溶解する。□2) そのゼラチンに綿棒を浸し充分に浸透させる。□3) その綿棒を紙タオルの上に数秒だけ横倒しにして側面の余液を除く。□4) シャーレ底面に絵文字を描く(強い筆圧で描く)。□5) 扇風機などを利用し完全に乾燥させる(最低20分間以上放置する)。
補足:乾燥後は室温保存が可能であり、これ以降の工程は分断的に考え「後日実施」という扱いでもよい。

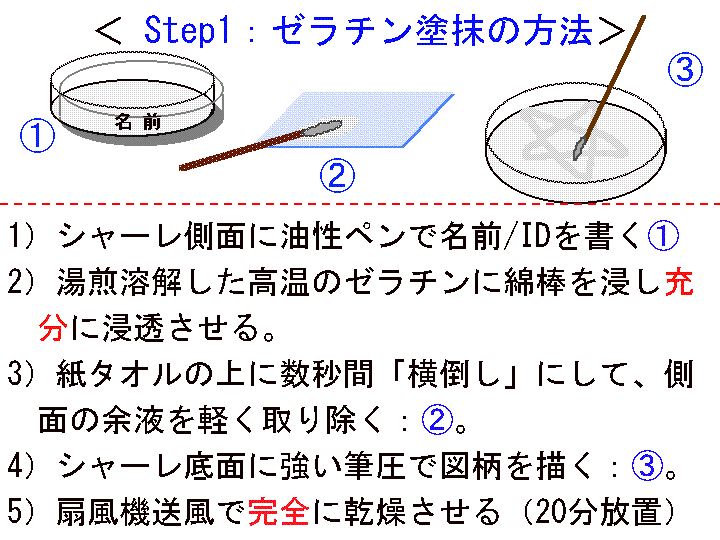
(画像クリックで拡大表示: 左 Fig.7 中 Fig.8 右 Fig.9 )
<先頭行へ移動>
□3)Step2:メチルセルロース (MC) 処理 (Fig10-12)
(血清アルブミンの代替としてメチルセルロースを用いる)
概要:□1) 塗抹ゼラチンが完全に乾燥したら、シャーレにMCを2ml程度加え全面に広げる。□2) 1分間ほど経過したらMCを捨てる/吸い取る。□3)中断なく次の工程へ進む。
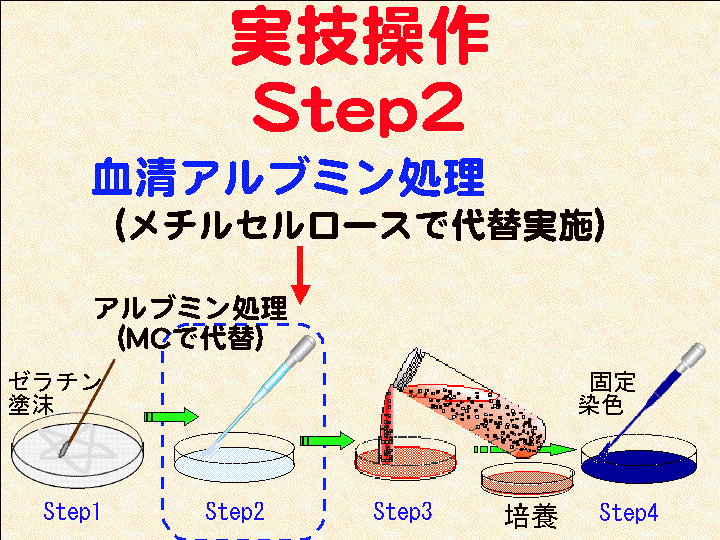
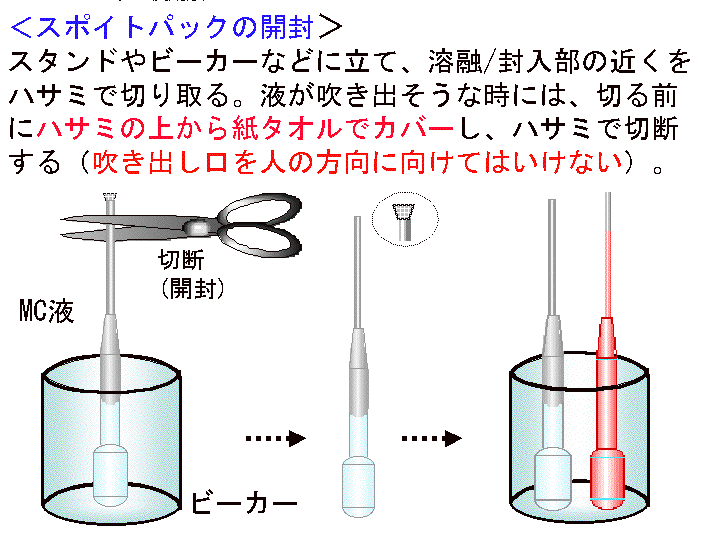
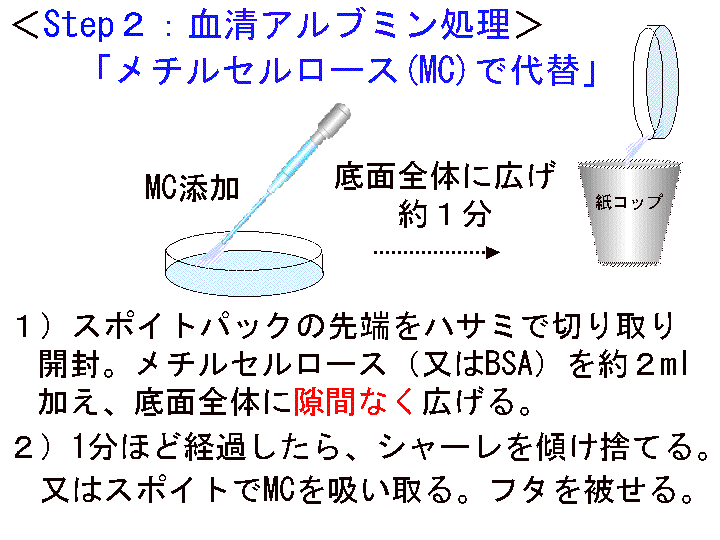
(画像クリックで拡大表示: 左 Fig.10 中 Fig.11 右 Fig.12)
<先頭行へ移動>
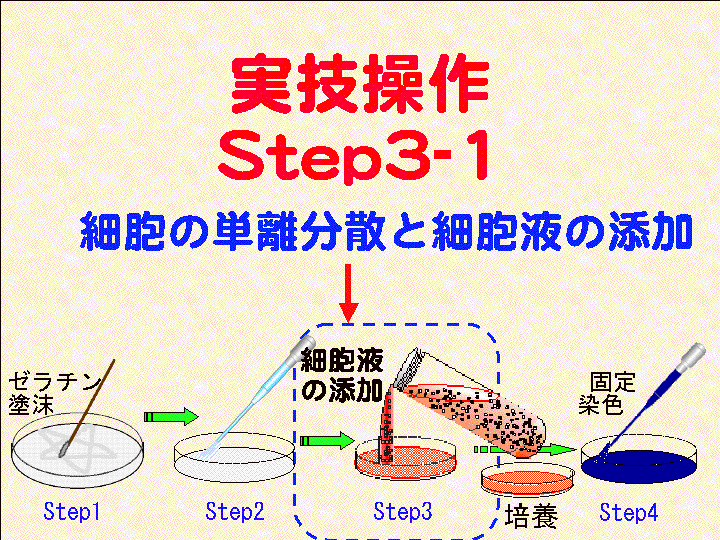
□4)Step3-1:細胞液の添加 (Fig13-15)
(フィルムバッグの開封 → 細胞の単離分散 → 細胞液の添加)
概要:□1) 細胞のフィルムバッグをビーカーに立てハサミで開封する。□2) スポイト先端を細胞液の中間まで差し込こみ「ポンピング処理:細胞の単離分散」を行なう。つまり、押しつぶしたポンピング部に約1秒1回のペースで約2.5mlの細胞液を吸引し、その後、強く吹き出す。この操作を13回程度繰り返す(この操作は重要である。吹き出す時は「強め」であることを意識する)。□3) 細胞液をシャーレに約6ml加える。□4) 所定の場所にシャーレを静置する:1次培養を開始する。その後は動かさない。
補足:(1)事前にポンピングに用いるスポイトの堅さや目盛りを確認する。(2)ポンピングの時、吸引が完了していない状態で「吹き出し」を行なうと泡だらけになるので、急がず行なうこと。吹き出しは「強め」でかまわない。(3)ポンピングでは人差し指中指-親指の3本指で行なう。(4)本工程が終了すると「1次培養」である。よって、事前に静置する場所の温度を確認する。培養温度は22℃から28℃(30℃を超えないこと)。
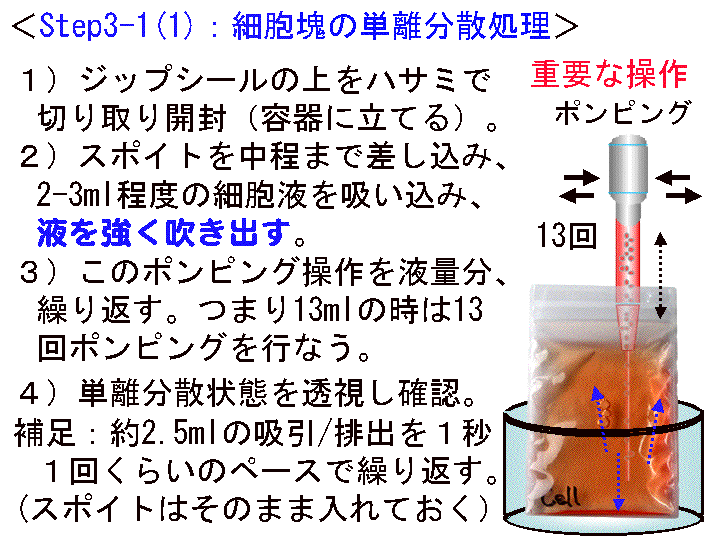
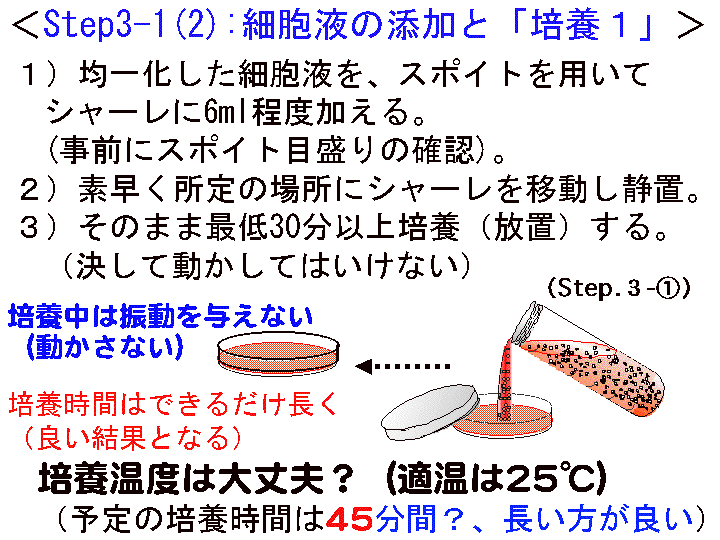
(画像クリックで拡大表示: 左 Fig.13 中 Fig.14 右 Fig.15 )
<先頭行へ移動>
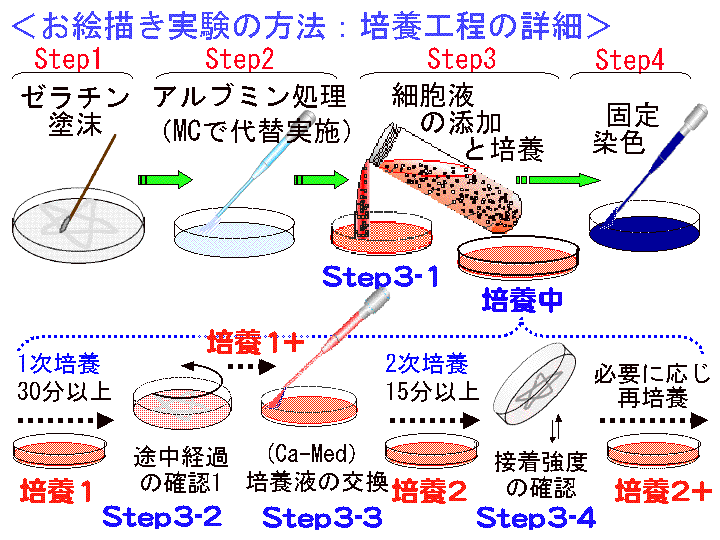
□5)培養1:1次培養(30分以上)
(開始時間__時__分、終了時間__時__分、培養温度約__℃)
概要:Step3-1が完了した状態、つまり培養時間(待ち時間)である。シャーレを所定温度/所定の場所に30分間以上静置する。この間、シャーレに振動を与えてはいけない(移動禁止)。できるだけ長く培養を継続すると良い結果となる。
補足:培養温度は可能なら25℃〜28℃を維持する。25℃以下(20℃以上)であっても培養時間を長く設定すれば問題はない。但し、30℃以上にならないよう配慮する。
(培養時間の設定法:考え方、は文末を参照:ココをクリック)
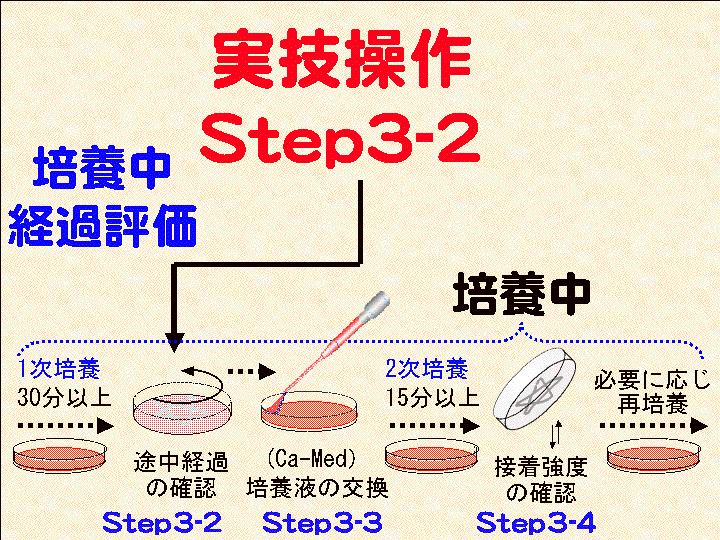
□6)Step3-2:途中経過の確認1(底面状態の評価) (Fig16-18)
概要:30分以上経過したら、シャーレをテーブルの上で回転させる。底面を肉眼で確認する(必要に応じて回転/確認を繰り返す)。形状が見えるはず。
補足:終了後は、観察記録や時間調整などのため、シャーレをそのまま放置しても良い。つまり、次の工程「培養1+:1次培養の継続」である。
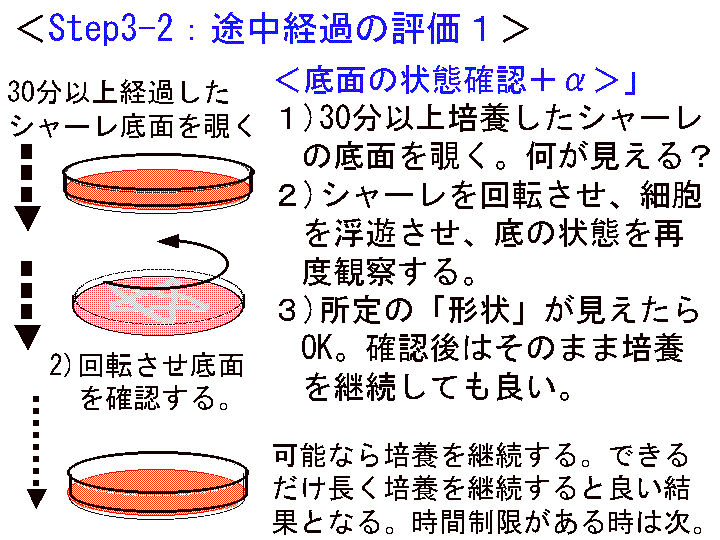

(画像クリックで拡大表示: 左 Fig.16 中 Fig.17 右 Fig.18 )
<先頭行へ移動>
□7)培養1+:1次培養の継続(必要に応じて行なう)
(実施しない or 実施した:__時__分〜__時__分)
概要:Step3-2(底面状態の評価)が終了した状態を維持する(シャーレを放置し培養を継続する)。継続時間は任意である。
補足:1次培養の目的は「細胞接着(運動)のための時間確保」であり、その最大効果を引き出すには最低60分間を必要とし90分程度で飽和期を迎える。よって、[培養1]と[培養1+]の合計時間が最低60分以上になるように配慮する。よって、例外的な言及として取り上げれば、例えば「翌日まで放置しても大丈夫」である(但しこれには状況判断が必要)。
□8)Step3-3:培養液の交換 (Fig19-21):カルシウム培養液(Ca-Med)へ
概要:□1) スポイトパック(Ca-Med)を開封する。□2) シャーレを動かし浮遊する細胞を含む培養液を別容器に回収する(又は捨てる)。□3) 底面に出現した「形」を肉眼で確認する(但し、乾燥させない)。□4) 終了後、シャーレに新しい培養液(Ca-Med)を5ml程度加える(出現した「形」に培養液を吹き付けてはいけない)。
補足:(1)液量5mlは厳密ではない。底面を十分に満たす液量と考える。(2) 回収した細胞はシャーレに残った接着細胞と基本的な差異はない。よって、再実験などに利用することも可能できる。
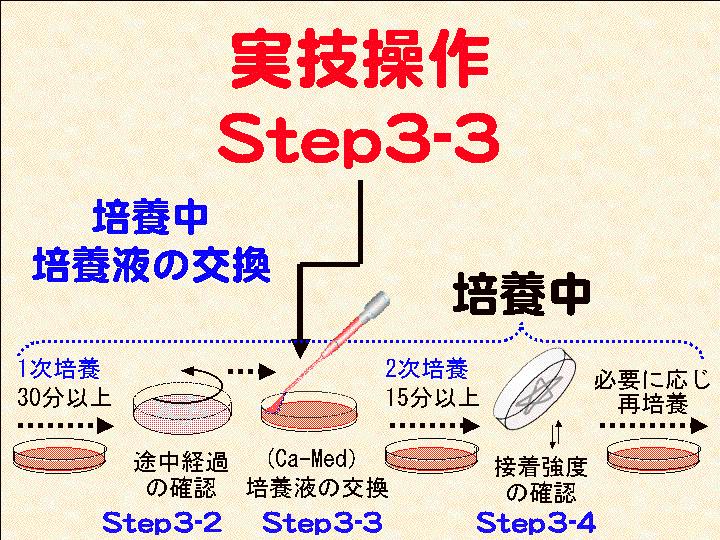

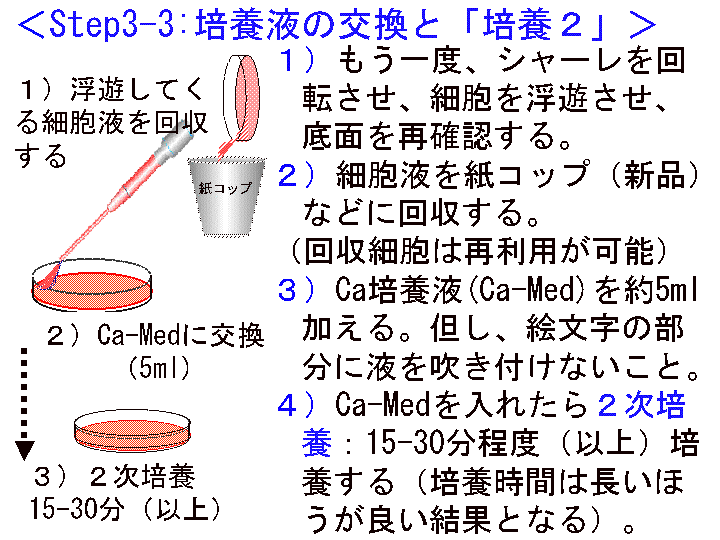
(画像クリックで拡大表示: 左 Fig.19 中 Fig.20 右 Fig.21)
<先頭行へ移動>
□9)培養2:2次培養(15分以上)
(開始時間__時__分:終了時間__時__分)
概要:Step3-3が完了した状態。そのまま15分以上培養(放置)する(30分以上が適切である)。[培養2]ではシャーレを動かしても支障はない。
補足:2次培養はCaイオンを十分量含む培養液に基づく細胞の自律的な活動時間であり、 細胞接着の強化と伸展配列に寄与する。倒立顕微鏡がある場合は、時々、観察を行なう。形態変化を観察することができる。
□10)Step3-4:途中経過の確認2 (Fig22-24) :接着強度の確認 (タッピング)
概要:□1) 培養2が15分以上経過したら、フタを取り外し、シャーレを逆さにして培養液をフタに入れる/回収する。□2) シャーレの角をテーブルに数回打ち付け、底面状態を肉眼的に確認する(細胞が流れ落ちる?)。□3) 確認後は培養液をシャーレに戻す。□4)フタ内面の液はティッシュペーパーなどできれいに拭き取る。
補足:この「タッピング処理」は数回までとする。細胞を乾燥させないこと。
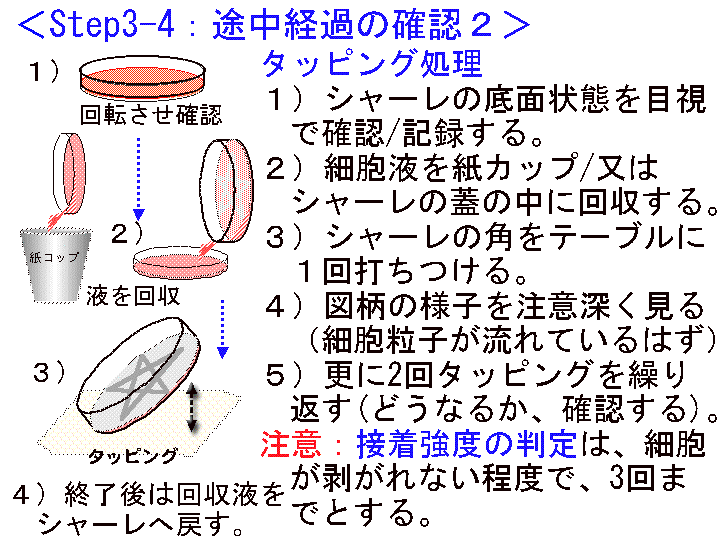

(画像クリックで拡大表示: 左 Fig.22 中 Fig.23 右 Fig.24 )
<先頭行へ移動>
□11) 培養2+:2次培養の継続(必要に応じて)
(実施しない or 実施した:__時__分〜__時__分)
概要:Step3-4が完了したシャーレを所定の場所に静置する(培養を継続する)。時間的に余裕がある時は行なう。時間は任意であるが、より長時間の設定はより良い結果に結びつく。
概要:固定液と染色液のスポイトパックを切断開封する時は、必ず紙タオルやビニール袋で被い、飛沫飛散の防止対策を講じた上で行なう。開封後のスポイト先端にキャップなどを取り付ける(Fig26を参照)。
□1)シャーレ内の培養液をスポイトを用いて半量程度捨てる。□2)固定液(G-Fix)を5滴程度加え、液を回転させ、2分程度放置する。□3)シャーレを水バケツに浸け水洗(液が手に着かないように注意する/大型ピンセットを使用)。□4)染色液(CV)を2ml程度加え全面に広げる。時々動かし全体をむらなく約2-3分間染色する。□5)水バケツに浸し水洗する(大型ピンセットを使用)。完成注意:固定染色では試薬溶液が飛び散らないよう十分に注意して操作する。就学者が扱う時は必ず諸注意を与える。
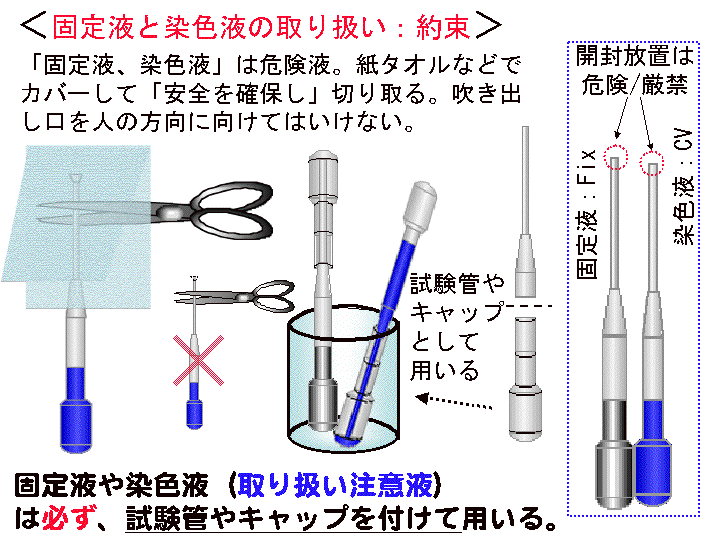
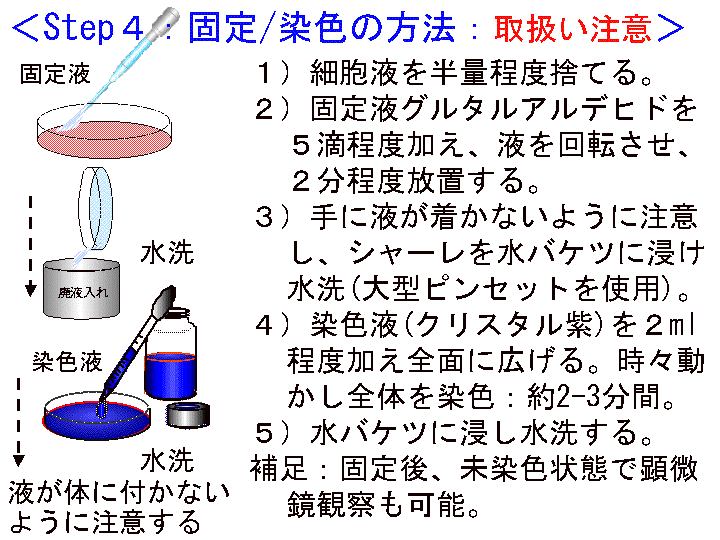
(画像クリックで拡大表示: 左 Fig.25 中 Fig.26 右 Fig.27)
<先頭行へ移動>
概要:水洗後でもシャーレ外側の水分を拭き取れば、シャーレ底面の外側から顕微鏡で観察可能。 乾燥後はシャーレ内に対物レンズを入れ観察する。顕微鏡像をカメラ機能などで記録する。
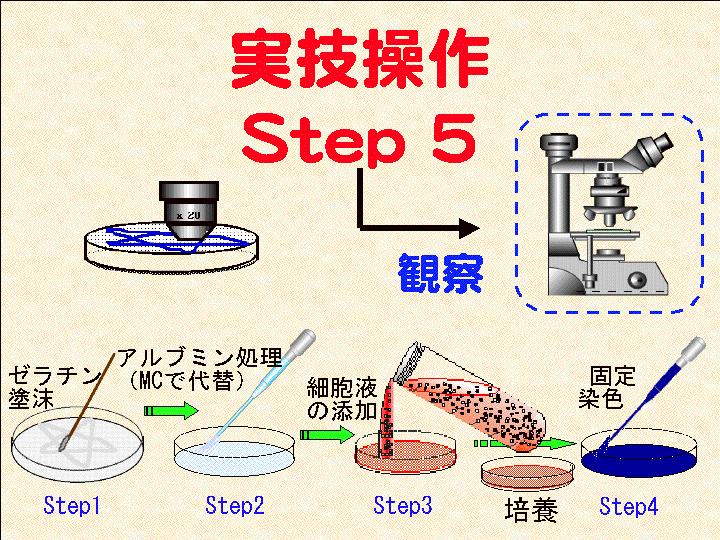
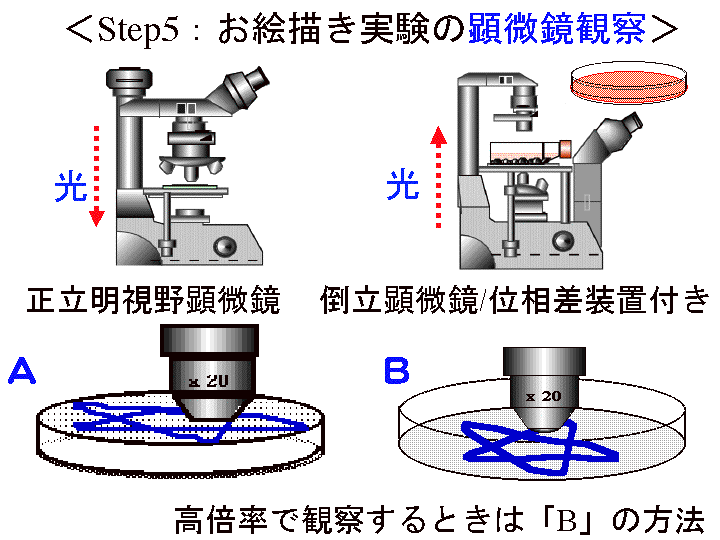
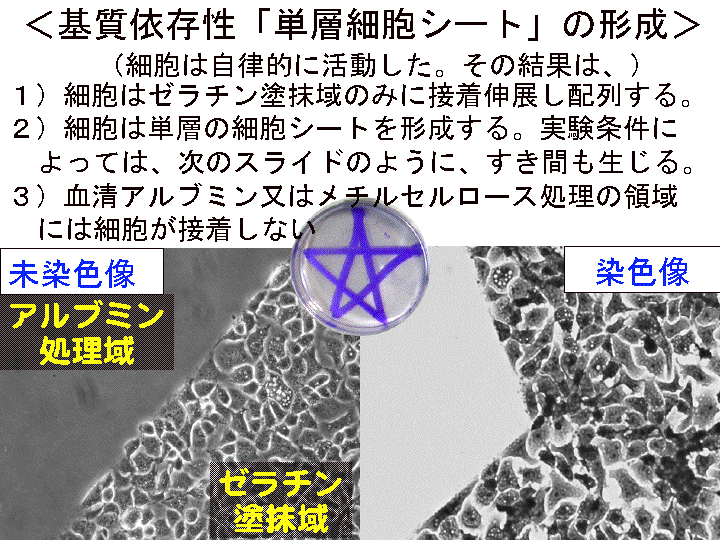
(画像クリックで拡大表示: 左 Fig.28 中 Fig.29 右 Fig.30 )
<先頭行へ移動>
-
本実験とその工程は、就学者に対する実験学習の観点から設計されている。つまり「迅速・簡便・実効的」であるを旨としている。しかし、細胞培養実験の常として「培養時間」、言わば「待ち時間」が付随する。これは「細胞の自律的な活動時間」であり基本的に時間短縮はできない。
-
そこで、本実験の「培養」工程には「途中経過の確認1, 2 (Step3-2, Step3-4)」を挿入し、その待ち時間を最低限としながら「途中経過」に対する考察や協議などを求める形式とした。
-
1次培養は「細胞接着期」である。ゼラチン基質に隙間なく密に細胞を接着させを目的とする。そのためには最低60分を必要とし、90分程度(以上)で飽和期を迎える。
-
よって、[培養1]を30分とした場合は、Step3-2終了後の[培養1+]では最低30分の継続培養を行なう。[培養1]を長時間設定とした場合は、[培養1+]を省略することも可能である。
-
2次培養は「細胞の伸展配列期」である。接着した細胞が扁平状に変化すると同時に隣接細胞と協調的に敷石状に配列「単層細胞シートの形成」を目的とする。これには最低15分を必要とするが、安定化を図るためは30分程度(以上)を必要する。
-
つまり、[培養2]を15分とした場合は、[培養2+]は最低15分の継続培養を行なう。[培養2]を長時間設定とした場合は、同様に[培養2+]を省略することができる。
-
学習時間が十分に確保できる場合は、上記に基づき、それぞれの培養時間を最大限とする事が望ましい。その培養時間(待ち時間)は解説/協議/考察などに利用する。
-
時間的な都合や制限がある場合は工程を分断的に取り扱う。つまり、「Step2からStep3-2」を実践的な要所(実験操作)として実施する。その所要時間は約50分である(Fig000)。その他の工程は事前準備や任意の担当者による事後処理として扱う。
-
ちなみに、本実験の培養時間で最も重要な工程は「培養1」であり、この工程が十分に長い場合は以降の工程において不備不具合は生じない。つまり、細胞は自律的に活動するが、その「足場」が十分に定まるとそれ以降の細胞運動は安定的に誘導される。
<先頭行へ移動>
以上で「お絵描き実験」実技操作マニュアルは終了



(画像クリックで拡大表示: 左 Fig.31 中 Fig.32 右 Fig.33 )
<先頭行へ移動>
<34-36>
*



(画像クリックで拡大表示: 左 Fig.34 中 Fig.35 右 Fig.36 )
<先頭行へ移動>
<37-39>
*



(画像クリックで拡大表示: 左 Fig.37 中 Fig.38 右 Fig.39 )
<先頭行へ移動>
<40-42>
*



(画像クリックで拡大表示: 左 Fig.40 中 Fig.41 右 Fig.42 )
<先頭行へ移動>
<43-45>
*



(画像クリックで拡大表示: 左 Fig.43 中 Fig.44 右 Fig.45 )
<先頭行へ移動>
<46-48>
*



(画像クリックで拡大表示: 左 Fig.46 中 Fig.47 右 Fig.48)
<先頭行へ移動>
<49-51>
*



(画像クリックで拡大表示: 左 Fig.49 中 Fig.50 右 Fig.51)
<先頭行へ移動>
<52-54>
*



(画像クリックで拡大表示: 左 Fig.52 中 Fig.53 右 Fig.54)
<先頭行へ移動>
<55-57>
*



(画像クリックで拡大表示: 左 Fig.55 中 Fig.56 右 Fig.57)
<先頭行へ移動>
<58-60>
*



(画像クリックで拡大表示: 左 Fig.58 中 Fig.59 右 Fig.60)
<先頭行へ移動>